Работа № 3. ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ РАСТВОРЕНИЯ СОЛИ В ВОДЕ
Целью работы является определение интегральной теплоты растворения нескольких солей с одинаковым катионом или анионом, что позволяет выяснить влияние природы второго иона на величину 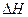 .
.
Теоретические сведения
Растворение одних веществ в других сопровождается тепловыми эффектами. Связано это с тем, что энергия межчастичного взаимодействия в чистых веществах ( 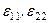 ) и в образованном из них растворе отличаются, то есть
) и в образованном из них растворе отличаются, то есть 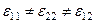 .
.
В теории растворов принято называть растворителем компонент с большей концентрацией, а растворенным веществом – компонент с меньшей концентрацией. В зависимости от условий образования раствора различают два вида теплот растворения. Теплоту, которая выделяется или поглощается при растворении одного моля вещества (при постоянных температуре и давлении) в чистом растворителе, взятом в количестве, необходимом для получения раствора заданного состава, называют интегральной теплотой растворения ( 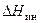 ).
).
Дифференциальной теплотой растворения ( 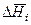 ) называют тепловой эффект растворения бесконечно малого количества вещества в растворе заданного состава, отнесенный к 1 молю растворяемого вещества. Дифференциальную теплоту нецелесообразно измерять непосредственно, ее рассчитывают по интегральным теплотам растворения. Для этой цели строят график зависимости теплового эффекта образования раствора
) называют тепловой эффект растворения бесконечно малого количества вещества в растворе заданного состава, отнесенный к 1 молю растворяемого вещества. Дифференциальную теплоту нецелесообразно измерять непосредственно, ее рассчитывают по интегральным теплотам растворения. Для этой цели строят график зависимости теплового эффекта образования раствора 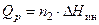 от числа молей растворенного вещества
от числа молей растворенного вещества 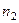 при постоянном количестве растворителя. Угол наклона касательной, проведенной к кривой при заданном значении
при постоянном количестве растворителя. Угол наклона касательной, проведенной к кривой при заданном значении 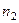 , дает дифференциальную теплоту растворения, так как
, дает дифференциальную теплоту растворения, так как
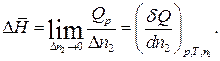 | (35) |
Можно предположить, что система поглощает теплоту для преодоления энергии межчастичного взаимодействия в растворяемом веществе при его растворении. Однако, наряду с процессом «разрыва» химических связей обычно происходит и другой, называемый сольватацией. Сольватация представляет собой сильное взаимодействие растворяемого вещества с растворителем и сопровождается выделением тепла. Если растворителем является вода, сольватация называется гидратацией.
Роль подобного взаимодействия растворителя с растворяемым веществом можно показать на примере растворения хлорида натрия в воде. В кристаллической решетке хлорида натрия катион натрия и анион хлора связаны друг с другом гетерополярной (ионной) связью. Энергия, необходимая для их разделения, настолько велика, что такие неполярные растворители как бензол, четыреххлористый углерод, не растворяют хлорид натрия. Однако растворитель, подобный воде, молекулы которой обладают высокой диэлектрической постоянной и большим дипольным моментом, сильно «притягивается» как к ионам натрия, так и к ионам хлора. В итоге происходит сольватация ионов, которая сопровождается значительным уменьшением энергии системы. Если энергия, требуемая для отрыва ионов от кристалла, приблизительно равна энергии сольватации, как в случае растворения NaCl в воде, значение суммарного теплового эффекта близко к нулю. При растворении NaCl в воде при 25ºС наблюдается лишь небольшое охлаждение, величина 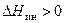 . При растворении же в воде Na2SO4 при 25ºC выделяется тепло, потому что теплота гидратации (
. При растворении же в воде Na2SO4 при 25ºC выделяется тепло, потому что теплота гидратации ( 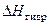 ) больше энергии отрыва ионов от кристалла.
) больше энергии отрыва ионов от кристалла.
Таким образом, растворение твердой соли в воде может быть представлено как результат наложения двух процессов. Переходя в жидкий раствор, соль изменяет агрегатное состояние, становясь жидкой. При этом система поглощает тепло, равное теплоте плавления соли ( 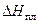 ). Далее ионы соли после «плавления» смешиваются с молекулами воды, причем тепловой эффект смешения (
). Далее ионы соли после «плавления» смешиваются с молекулами воды, причем тепловой эффект смешения ( 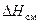 ) для солей, как правило, отрицателен (
) для солей, как правило, отрицателен ( 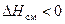 ). Другими словами, знак суммарного теплового эффекта (интегральной теплоты растворения) зависит от соотношения величин
). Другими словами, знак суммарного теплового эффекта (интегральной теплоты растворения) зависит от соотношения величин 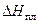 и
и 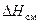 , так как
, так как
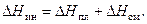 | (36) |
Если растворять соли с общим катионом или анионом, то величина теплового эффекта будет определяться природой второго иона, входящего в соединение. Чем он сильнее (сила иона оценивается по отношению заряда к радиусу), тем прочнее связан в соединении, а значит, тем больше энергии требуется затратить на плавление (разрушение решетки соли). С другой стороны, более сильный ион образует более прочные связи с диполями воды, что увеличивает теплоту смешения. Общее изменение теплового эффекта при переходе от одной соли к другой будет определяться изменением теплот плавления и гидратации.
Методика проведения опытов
Для определения интегральной теплоты растворения используется простейший калориметр, состоящий из внутреннего 3 (рис. 6) и наружного стакана 1. Сверху стаканы закрыты крышкой из материала с малой теплопроводностью. В крышке имеются два отверстия: одно для воронки, через которую засыпают навеску соли, через второе в термостат вводится термопарный датчик 4 (он позволяет находить изменение температуры в процессе растворения соли). Перемешивание жидкости в стакане 3 осуществляется магнитной мешалкой 2. Величины ЭДС датчиков регистрируются цифровым вольтметром 5. Показания последнего заносятся в таблицу первичной информации «  ».
».
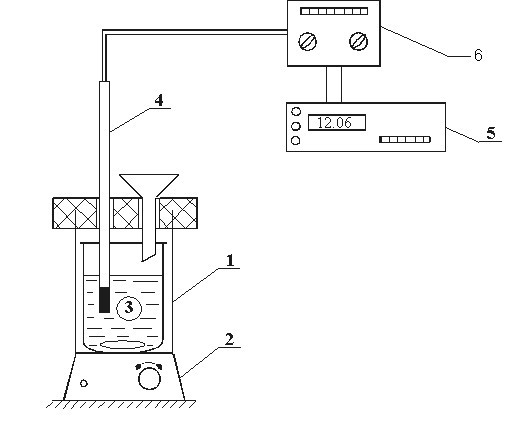
Рис.6. Схема установки для определения теплоты растворения: 1 – калориметр; 2 – магнитная мешалка; 3 – стеклянный стакан; 4 – термобатарея; 5 – вольтметр; 6 – усилитель сигнала
Используемые медь‑константановые термопары обладают линейной зависимостью ЭДС от температуры, и значение коэффициента 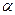 в уравнении
в уравнении
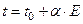 | (37) |
указывается на используемом приборе. В этом уравнении величина 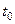 соответствует температуре спаев термопар, находящихся вне калориметра, а
соответствует температуре спаев термопар, находящихся вне калориметра, а 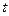 – температура «рабочих» спаев, помещенных в раствор.
– температура «рабочих» спаев, помещенных в раствор.
Для проведения опытов необходимо приготовить навески солей в расчете на 300 мл воды при конечной концентрации соли, равной 0,20 М. Используемые соли должны быть сухими и тщательно растертыми в фарфоровой ступке. Наличие крупных кусочков соли увеличивает время растворения и приводит к дополнительным ошибкам в определении теплоты растворения.
После приготовления требуемых навесок солей во внутренний стакан наливают 300 мл дистиллированной воды, закрывают термостат крышкой, включают магнитную мешалку и фиксируют в течение 7 минут показания приборов. При использовании цифрового вольтметра 5 удобнее записывать в таблицу величины через каждую минуту. Далее, на седьмой минуте следует засыпать соль и продолжать фиксировать показания прибора. После введения соли рекомендуется 4-6 замеров сделать через 30 секунд, а остальные – через минуту, закончив замеры через 10-12 минут после засыпки соли.
Расчет интегральной теплоты растворения производят по формуле
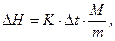 | (38) |
где 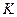 – постоянная калориметра;
– постоянная калориметра; 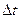 – изменение температуры при растворении;
– изменение температуры при растворении; 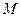 – молекулярный вес соли;
– молекулярный вес соли; 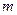 – навеска соли в граммах.
– навеска соли в граммах.
Постоянная калориметра характеризует количество тепла, необходимое для повышения температуры внутри калориметра на один градус. Её определяют, внося в калориметр фиксированное количество тепла (например, пропуская через электрическое сопротивление ток в течение определенного времени) и определяя одновременно повышение температуры. Численное значение постоянной дается преподавателем или определяется студентами по величине 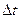 растворения «стандартной» соли.
растворения «стандартной» соли.
Изменение температуры 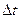 при растворении определяют графически. Поскольку температура раствора пропорциональна величине измеряемой ЭДС, строят график непосредственно в координатах «
при растворении определяют графически. Поскольку температура раствора пропорциональна величине измеряемой ЭДС, строят график непосредственно в координатах « 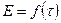 ».
».
Из графика следует, что время опыта делится на три периода. В первом периоде до момента засыпки соли ( 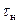 ) наблюдается равномерное увеличение температуры (ЭДС) за счет выделения тепла при вращении мешалки в воде. При добавлении соли в момент
) наблюдается равномерное увеличение температуры (ЭДС) за счет выделения тепла при вращении мешалки в воде. При добавлении соли в момент 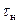 наблюдается интенсивное снижение температуры и по окончании растворения (
наблюдается интенсивное снижение температуры и по окончании растворения ( 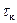 ) наблюдается ее монотонное увеличение.
) наблюдается ее монотонное увеличение.
Очевидно, что в процессе растворения раствор обменивается теплом со средой, поэтому для расчета 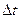 необходимо по опытным данным построить гипотетическую зависимость
необходимо по опытным данным построить гипотетическую зависимость 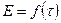 для «мгновенного» растворения.
для «мгновенного» растворения.
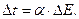 | (39) |
С этой целью определяют время конца растворения 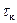 как точку, в которой зависимость «
как точку, в которой зависимость « 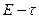 » становится линейной. По графику находят середину второго периода и восстанавливают перпендикуляр к оси абсцисс до пересечения с продолжением линии равномерного изменения температуры (ЭДС) в I и III периодах. Определив таким методом величину
» становится линейной. По графику находят середину второго периода и восстанавливают перпендикуляр к оси абсцисс до пересечения с продолжением линии равномерного изменения температуры (ЭДС) в I и III периодах. Определив таким методом величину 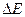 и зная температурный коэффициент термопары, рассчитывают понижение температуры
и зная температурный коэффициент термопары, рассчитывают понижение температуры
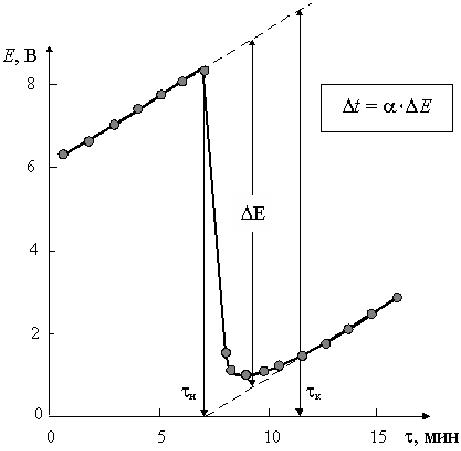
Рис.7. Зависимость E от времени наблюдения. По изменению ЭДС – ΔE находят Δt
Найденные опытным путем теплоты растворения солей вносят в таблицу 4 и оценивают абсолютную и относительную погрешности их определения, сопоставляя полученные результаты с табличными данными, приведенными в прил. 3 настоящего руководства.
Таблица 4
Результаты опыта
| Исследуемая соль | Теплота растворения, кДж/моль | 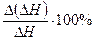 | |
| Справочные данные | 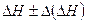 | ||
Отчет о работе завершают выводами.
Вопросы для самоконтроля
1. Что называют интегральной и дифференциальной теплотами растворения?
2. Как связана прочность кристаллической решетки соли и теплота ее растворения?
3. Какое влияние оказывает природа катиона или аниона на теплоту растворения соли?
4. Известно, что при растворении двух солей с общим катионом для соли с более слабым анионом теплота растворения выше. Что можно сказать о влиянии природы аниона на соотношение теплот плавления этих солей и смешения их с водой?
5. В чем суть калориметрического определения теплоты растворения? Как определить величину 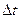 , необходимую для расчета теплоты?
, необходимую для расчета теплоты?
РАСТВОРЫ
