Аналитическое выражение II закона термодинамики.
Для обратимого цикла Карно имеем:
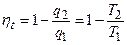 ,
,
тогда 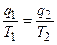 или
или 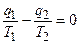 .
.
Если учесть в этом соотношении, чтоq1 >0 (теплота подводится к рабочему телу) и q2<0 (теплота отводится от рабочего тела), то
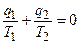 или
или 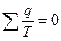 (4.6)
(4.6)
Отношение подводимой или отводимой теплоты к соответствующей абсолютной температуре называется приведенной теплотой. Выражение (6.6) показывает, что алгебраическая сумма приведенных теплот для обратимого цикла Карно равна нулю, т.е.
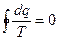 . (4.7)
. (4.7)
Отношение 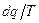 считают полным дифференциалом функции состояния
считают полным дифференциалом функции состояния 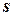 , называемой энтропией. Т.к. dq = Tds, то
, называемой энтропией. Т.к. dq = Tds, то
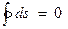 (4.8)
(4.8)
Таким образом, алгебраическая сумма приведенных теплот для любого обратимого цикла равна нулю. Энтропия рабочего тела в результате совершения произвольного обратимого цикла не изменяется.
Уравнение (4.8), выведенное Клаузиусом в 1854 году, представляет собой аналитическое выражение второго закона термодинамики для произвольного обратимого цикла и называется первым интегралом Клаузиуса.
В цикле с необратимыми процессами при прочих равных условиях работа, совершаемая рабочим телом меньше, чем в цикле с обратимым процессом, и при одинаковх температурах источника теплоты и холодильника
h tнеобр<ht.
Поэтому при наличии в цикле необратимых процессов:
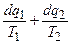 <0 (4.9)
<0 (4.9)
или после интегрирования по контуру
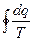 <0(4.10)
<0(4.10)
Это неравенство представляет собой аналитическое выражение второго закона термодинамики для произвольного необратимого цикла и называется вторым интегралом Клаузиуса.
Объединяя (4.7) и (4.10), можно записать одно уравнение второго закона термодинамики для обратимых (=) и необратимых (<) циклов:
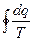 £0 (4.11)
£0 (4.11)
Энтропия есть функция состояния рабочего тела, поэтому изменение энтропии как для обратимого, так и необратимого процессов будет одним и тем же.
Для элементарного необратимого процесса
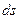 >
> 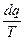 (4.12)
(4.12)
В общем виде для любого процесса изменение энтропии удовлетворяет соотношению
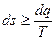 , (4.13)
, (4.13)
где dq - количество теплоты, полученное телом от источника теплоты;
Т- абсолютная температура источника теплоты.
Знак равенства относится к обратимым, знак неравенства - к необратимым процессам.
Следует различать понятия энтропия телаи энтропия системы.
Энтропия не является функцией состояния системы, состоящей из нескольких тел (рабочее тело, холодильники и источники теплоты), каждое из которых характеризуется своими параметрами. Поэтому на изменение энтропии системы влияет характер процесса теплообмена между рабочим телом и источником теплоты. При протекании обратимых процессов энтропия системы остается постоянной; при необратимых процессах энтропия системы возрастает.
Если в адиабатной изолированной системе протекают только обратимые процессы, то
ds = dq/T,
для адиабатной системы это уравнение принимает вид: dq = Tds = 0
Так как Т ¹ 0, то для всей системы ds = 0 и s = const.
Таким образом, если в изолированной адиабатной системе протекают только обратимые процессы, то энтропия всей системы остается величиной постоянной.
Для адиабатной системы при наличии в ней необратимых процессов:
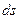 >
> 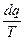 .(4.14)
.(4.14)
Т.к.dq = 0, то для адиабатной изолированной системы ds ³ 0, т.е. происходит увеличение энтропии.
В термодинамике большое значение имеет понятие работы, которую совершает система при изменении своего состояния и условий, при которых получается максимальная работа.
Максимальная работоспособность системы, получаемая в обратимом цикле Карно в температурном интервале от 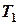 до
до 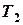 , называется эксергией (ex).
, называется эксергией (ex).
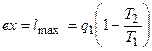 . (4.15)
. (4.15)
Работа необратимого цикла Карно, в котором теплота 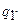 передается рабочему телу при температуре
передается рабочему телу при температуре 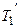 ниже температуры нагревателя
ниже температуры нагревателя  :
:
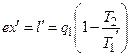 . (4.16)
. (4.16)
Потеря работы :
 . (4.17)
. (4.17)
Эксергия является обобщенной качественной и количественной характеристикой для потока теплоты и потока вещества, зависящей одновременно от параметров системы и окружающей среды. В отличие от энергии в реальных процессах, эксергия количественно не сохраняется. Всякая необратимость в системе приводит к уменьшению работоспособности, т.е. к потерям энергии. Уменьшение работы ведет к увеличению энтропии  :
:
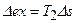 . (4.18)
. (4.18)
Уравнение (4.18) называют уравнением Гюи-Стодолы.
