Теплоемкость при постоянном давлении и при постоянном объеме. Уравнение Майера
Как было отмечено ранее, теплоемкость зависит от характера термодинамического процесса, при котором подводится или отводится теплота, поэтому при экспериментальном определении ее значения обычно используют два термодинамических процесса: v = const и P = const. Значения теплоемкостей сv и cp для различных веществ сведены в таблицы и имеются в справочной литературе.
Известно, что 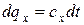 (см. уравнение 1.34). Тогда для изохорного процесса:
(см. уравнение 1.34). Тогда для изохорного процесса:
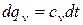 (1.39)
(1.39)
Подведенная при постоянном объеме теплота, когда dl=0, расходуется только на изменение внутренней энергии du, поскольку в соответствии с первым законом термодинамики
dq = du + dl. (1.40)
Тогда, в соответствии с (1.40) имеем:
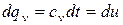 . (1.41)
. (1.41)
Для изобарного процесса:
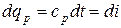 . (1.42)
. (1.42)
При P = const некоторое количество теплоты идет также на совершение работы, поэтому для изменения температуры рабочего тела на 1К при P = const требуется большее количество теплоты, чем при v = const и, следовательно, cp>сv.
Исходя из уравнений (1.40, 1.41, 1.42) и 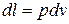 , имеем:
, имеем:
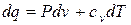 . (1.43)
. (1.43)
Так как из уравнения состояния 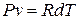 , то для идеального газа далее получаем:
, то для идеального газа далее получаем:
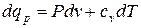
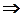
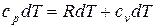
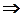
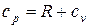 .
.
Или:
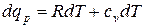
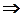
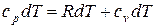
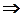
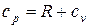 .
.
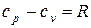 (1.44)
(1.44)
Выражение (1.44) называют уравнением Майера.
Т.е. для изменения температуры рабочего тела в интервале температур от  до
до  в изобарном процессе 1-2Р (рис. 1.4) требуется большее количество теплоты, чем в изохорном процессе 1-2v. Это видно из изображения процессов в
в изобарном процессе 1-2Р (рис. 1.4) требуется большее количество теплоты, чем в изохорном процессе 1-2v. Это видно из изображения процессов в 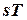 -диаграмме. Площадь, ограниченная кривой процесса и осью абсцисс, представляет собой количество теплоты, участвующей в процессе, и
-диаграмме. Площадь, ограниченная кривой процесса и осью абсцисс, представляет собой количество теплоты, участвующей в процессе, и 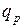 >
> 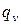 , т.е. пл.12ps2ps1> 12vs2vs1
, т.е. пл.12ps2ps1> 12vs2vs1
В термодинамике часто используется отношение теплоемкости при постоянном давлении и постоянном объеме:
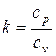 . (1.45)
. (1.45)
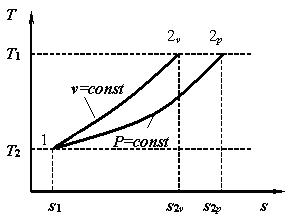
Рисунок 1.4 - К вычислению количества теплоты в термодинамическом процессе
С учетом изложенного выше, первый закон термодинамики может быть представлен в виде:
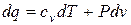 ,
,
или
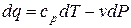 . (1.46)
. (1.46)
В упрощенных расчетах используются постоянные значения мольных теплоемкостей, не зависящих от температуры (табл. 1.2).
Постоянные значения мольных теплоемкостей и показатель адиабаты 
Таблица 1.2 – Постоянные значения мольных теплоемкостей
| Атомность газа | Мольная теплоемкость, кДж/моль×К | 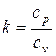 | |
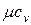 | 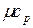 | ||
| Одноатомный | 12,5 | 20,8 | 1,67 |
| Двухатомный | 20,8 | 29,1 | 1,4 |
| Многоатомный | 25,0 | 33,3 | 1,33 |
Теплоемкости cpи сv не зависят ни от объема, ни от давления, а являются однозначной функцией температуры c = ¦(T).
Отношение количества теплоты 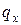 , подведенной или отведенной в данном процессе, к соответствующему изменению температуры
, подведенной или отведенной в данном процессе, к соответствующему изменению температуры 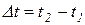 называется средней теплоемкостью тела в данном процессе х:
называется средней теплоемкостью тела в данном процессе х:
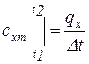 .
.
Индекс т означает medium – средняя.
Предел, к которому стремится средняя теплоемкость при 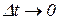 называется истинной теплоемкостью тела в данном процессе х:
называется истинной теплоемкостью тела в данном процессе х:
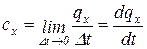 . (1.47)
. (1.47)
В таблице 1.3 приведена классификация различных видов теплоемкости в зависимости от единиц количества вещества (массовые, объемные и мольные), температуры (истинные и средние) и процесса (изохорные и изобарные).
Таблица 1.3 - Классификация теплоемкостей
| Теплоемкость | Массовая, кДж/(кг×К) | Объемная, кДж/(м3×К) | Мольная, кДж/(моль×К) | |||
| истинная | средняя | истинная | средняя | истинная | средняя | |
| Изохорная | 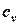 | 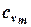 | 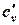 | 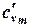 | 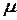 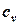 | 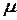 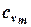 |
| Изобарная | 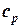 | 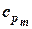 | 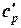 | 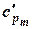 | 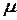 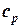 | 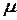 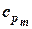 |
Для многих теплотехнических расчетов зависимость 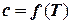 принимают линейной так, что
принимают линейной так, что
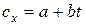 .
.
Теплоемкость смеси газов
При расчетах тепловых установок приходится встречаться со смесями газов, а в таблицах приводятся значения теплоемкости только для отдельно взятых идеальных газов, поэтому важно уметь определять теплоемкость газовой смеси.
Если смесь газов задана массовыми долями, то удельная теплоемкость смеси определяется как сумма произведений массовых долей и удельной теплоемкости каждого газа:
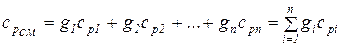 ; (1.48)
; (1.48)
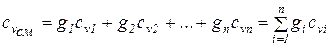 . (1.49)
. (1.49)
Если смесь газов задана объемными долями, то объемная теплоемкость смеси равна сумме произведений объемных долей и объемной теплоемкости каждого газа:
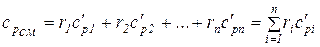 ; (1.50)
; (1.50)
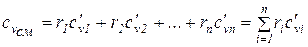 . (1.51)
. (1.51)
Молярная теплоемкость смеси газов равна произведению объемных долей и молярных теплоемкостей составляющих смесь газов:
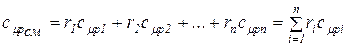 (1.52)
(1.52)
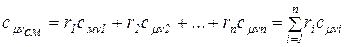 (1.53)
(1.53)
Удельная теплоемкость смеси газов может быть определена, если известны плотность и удельный объем смеси газов при нормальных физических условиях:
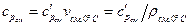 ; (1.54)
; (1.54)
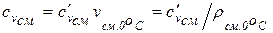 (1.55)
(1.55)
Литература: [2], с. 6-20; [5], с. 3-4, 9-12; [6], с. 5-13; [8], с. 5-30, 43-54.
Вопросы для самоконтроля
1. Перечислите параметры, которыми характеризуется состояние рабочего тела или вещества.
2. Что понимается под термодинамической системой?
3. Что представляет собой равновесное и неравновесное состояния термодинамической системы?
4. Что такое газовая смесь? Способы задания газовых смесей.
5.  Что такое "неравновесный процесс"?
Что такое "неравновесный процесс"?
6. Расшифруйте понятия "равновесный процесс", "неравновесный процесс".
7. Дайте определения обратимых и необратимых процессов.
8. Каковы условия обратимости процессов?
9. В чем отличие понятий "истинная" и "средняя" теплоемкости?
10.Какие теплоемкости вам известны?
11.Как вычислить теплоемкость смеси идеальных газов?
12.Каков физический смысл газовой постоянной?
13.В чем физический смысл уравнения Майера?
2 ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
