Теплота и работа как формы передачи энергии.
При протекании термодинамического процесса в общем случае тела, участвующие в этом процессе, обмениваются между собой энергией. В результате этого обмена энергия одних тел увеличивается, а других - уменьшается. Передача энергии в процессе от одного тела к другому может происходить двумя способами.
Первый способ передачи энергии реализуется при непосредственном контакте тел, имеющих различную температуру, путем обмена кинетической энергией между молекулами соприкасающихся тел. При этом энергия передается от более нагретого тела к менее нагретому. Поскольку передача энергии этим способом происходит на молекулярном уровне без видимого движения тел, ее называютмикрофизической формой передачи энергии.
Количество энергии, переданной первым способом от одного тела к другому, называется количеством теплоты, или просто теплотой, а сам способ - передачей энергии в форме теплоты. Количество энергии, полученное телом в форме теплоты, называется подведенной теплотой, а количество энергии, отданное телом в форме теплоты, - отведенной теплотой. Теплота, так же как и любая другая энергия, измеряется в джоулях или килоджоулях (кДж). Принято обозначать произвольное количество теплоты через Q, а удельное (отнесенное к 1кг) - через q. Подведенная теплота считается положительной, а отведенная - отрицательной.
Второй способпередачи энергии связан с наличием силовых полей или внешнего давления. Для передачи энергии этим способом тело должно либо передвигаться в силовом поле, либо изменять свой объем под действием внешнего давления. Иначе говоря, в этом случае передача энергии происходит при условии перемещения всего тела или его части в пространстве. Поэтому второй способ является макрофизической формой передачи энергии. Этот способ называется передачей энергии в форме работы, а количество переданной энергии в процессе - работой.
Количество энергии, полученное телом в форме работы, будем называть совершенной над телом работой, а отданную энергию в форме работы - затраченной телом работой. Работа также измеряется в Дж или кДж. Затраченная телом работа считается положительной, а совершенная над телом работа - отрицательной.
Произвольное количество энергии, переданное в форме работы, обозначают через L, а удельное - через l.
В общем случае передача энергии в форме теплоты и в форме работы может происходить одновременно. При этом важно, что в различных термодинамических процессах, в зависимости от условий их протекания, количество теплоты и работы будет также различно. Следовательно, теплота и работа являются функциями процесса. Если процесса нет, то нет ни теплоты, ни работы.
Определения и основные законы идеальных газов.
Подидеальными понимают такие газы, в которых силы междумолекулярного притяжения и отталкивания отсутствуют, а сами молекулы, имея массу, не имеют объема.
Любой реальный газ, давление которого мало (Р®0), а удельный объем велик (v®¥), близок по свойству к идеальному газу. В этом состоянии силы, действующие между молекулами реального газа, так же как и объем молекул по сравнению с объемом занимаемого газом пространства, весьма малы. Не только при весьма малых давлениях, но и при обычных нормальных давлениях некоторые газы (гелий, водород, азот, кислород) близки по своим свойствам к идеальным.
К основным законам идеальных газов относятся законы Бойля-Мариотта, Гей-Люссака и Шарля. Идеальные газы полностью подчиняются этим законам.
В 1664 году английским физиком Бойлем и в 1676 году французским химиком Мариоттом независимо друг от друга была установлена зависимость между удельным объемом и абсолютным давлением идеального газа в процессе, протекающем при постоянной температуре: T = const. При постоянной температуре объем, занимаемый идеальным газом, изменяется обратно пропорционально его давлению:
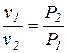 (1.9)
(1.9)
или при T = const произведение удельного объема и давления есть величина постоянная:
P1v1 = P2v2 , Pv = const(1.10)Графически в системе координат vP закон Бойля-Мариотта изображается равнобокой гиперболой. Эта кривая получила название изотермы (рис. 2.1), а процесс, протекающий при постоянной температуре, называется изотермическим.
В 1802 году французским физиком Гей-Люссаком был открыт экспериментальным путем закон, устанавливающий зависимость между удельным объемом и абсолютной температурой в процессе, протекающем при постоянном давлении Р = const.
При постоянном давлении объемы одного и того же количества идеального газа изменяются прямо пропорционально абсолютным температурам: 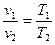

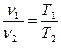 (1.11)
(1.11)
Графически в системе координат vPзакон Гей-Люссака изображается прямой, параллельной оси абсцисс. Эту прямую называют изобарой, а сам процесс, протекающий при постоянном давлении - изобарным.
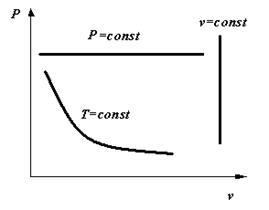
Рисунок 1.3 - Изотермический и изобарный процессы в vP-диаграмме
