Uu J. W., W. H. Yap, T. Thanabalu, A. G. Porter
1996. Efficient synthesis of mosquitocidal toxins in Asticcacaulis excentricus demonstrates potential of gramnegative bacteria in mosquito control, Nat. Biotechnoi 14:343-347.
Maeda S. 1995. Further development of recnmbi-nant baculoviniK insecticides. Curr. Opln. Biotechnoi. 6:313-319.
McCutchen B, F., P. V.Choudarj, IÎ. Crenshaw,
D. Maddox, S. G. Kamita, N. Palekar, S. Vclrath,
E. Fowler, B, D. Hammock, S. Maeda.1991. Development of a recombinant baculovirus expressing an insect-selective neurotoxin: potential for pest control. Bio/Technology 9: 848-852.
MettusA. M., A. Macafuso. 1990 Expression of Bacillus thuringiensis й-endntoxin genes during vegetative growth. Appl. Environ. Microbiol. 56: 1128-1134.
Murphy R. C., E. S. Stevens.1991. Cloning and expression of the crylVD gene of Bacillus thuringiensi!, suhsp. Kraelenxis m the cyanobac-• .im Л, -ut 'uin νιΐί>··ΙηψΙΐ(·, tut Ά Ί ;-mu i:.'. resulting larvicidal activity, Appl. Environ. Microbiol. 58: 1650 1655.
Otxikowic/ M. ti., F. J. Perlak, K. Kusaiio-Kretymer, E. J. Mayer, S. L· Bolten, L· S. Watrud. 1986. Tn5-mediated integration of the delta-endotoxin gene from Bacillus thuringiensis into the chromosome of root-colonizing pseudomonads. J. Bacterial. 168: 982-989.
Obukowicz M. G., F. J. Perlak, K. Kusano-Kretzmer, E. J. Mayer, L. S. Watrud. 1986. Integration of the delta-endotoxin gene of Bacillus ihuringiensis into the chromosome of root-colonizing strains of pseudomonads using Tn5. Gene 45: 327-33).
Priest F. G. 1992. Biological control of mosquitoes and other biting flies by Bacillus .sphaericus and Bacillus thuringiensls. J. Appl. Bacterial. 72: 357-369.
Schnepf H. E.f H. R. Whiteley. 1981. Cloning and expression of the Bacillus thuringiensis crystal protein gene in Escherichia coli. Proc. Natt. Acad. Sei. USA 78: 2893-2897.
Stewart L. M. D., M. Hisrt, M. L. Ferber, A. T. Merryweather, P. J. Cayley, R, D. Possee. 1991. Construction of an improved baculovirus insecticide containing an insect-specific toxin gene. Nature 352: 85-88.
Thanabalu T., J. Hindley, S. Brenner, C. Oei, C. Berry. 1992. Expression of the mosquitocidal toxins of Bacillus sphaericus and Bacillus Ihuringiensis subsp. israelensis by recombinant Caulobacter crescentus, & vehicle for biological control of aquatic insect larvae. Appl. Environ. Microbiol. 58:905-910.
Thiery I., L. Nicholas, R. Kippka, N. Tandeau de Marsac. 1991. Selection of cyanobacteria isolated from mosquito breeding sites as a potential food source for mosquito larvae. Appl. Environ. Microbiol. 57: 1354-1359.
Tomalski M. D., L. K. M U 1er. 1991. Insect paralysis by baculovirus-mediated expression of a mite neurotoxin gene. Nature 352: 82 -84.
Van Rie J., W. H. McGaughey, D. E. Johnson, B. I). Harriett, H. Van Mdlaert. 1990. Mechanism of inscel resistiinee of the microbial inscelieide Bacillus thuringiensis. Science 247: 72—74.
Wood Η. Α., R. R. Granados. 1991. Genetically engineered baculoviruses as agents fbr pest control. Annu. Rev. Microbiol. 45: 69-87.
Yap W. H., T. Thanabalu, A. G. Porter. 1994. Expression of mosquitocidal toxin genes in a gas vacuolatcd strain i>t Ancylobactcr aquaticus. Appl. Environ. Microbiol. 60; 4199-4202.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Каковы преимущества биологических инсектицидов перед химическими?
2. Почему токсин Bacillus thuringiensis не токсичендля человека?
3. Какой подход вы использовали бы для идентификации гена протоксина Bacillus thuringiensis subsp. israilensis? Какое практическое применение может найти этот ген?
4. Как выяснить, где локализован ген определенного протоксина: в плазмиде или в хромосомной ДНК B. thuringiensis?
5. Как с помощью генной инженерии можно улучшить полезные свойства того или иного протоксина В. thuringiensis?
6. Как, используя методы генной инженерии, повысить эффективность бакуловирусов как инсектицидных агентов?
7. Каким образом можно расширить видоспецифичность токсинов?
348 ГЛАВА 15
8. Какую информацию вы можете получить, зная, к какому классу относится тот или иной белок Cry?
9. Как бы вы модифицировали белок Cry, чтобы уменьшить вероятность появления насекомых, утойчивых к токсину?
10. Почему бактерия Asticcacaulis excentricus является весьма привлекательным микроорганизмом для осуществления в ней экспрессии генов токсинов В. thuringiemis?
11. Как расширить круг насекомых, инфицируемых данным бакуловирусом?
ГЛАВА 16.
Промышленный синтез белков при участии рекомбинантных микроорганизмов
Для получения коммерческих продуктов с помощью рекомбинантных микроорганизмов необходимо сотрудничество специалистов в двух областях: молекулярных биологов и биотехнологов. Задача молекулярных биологов заключается в идентификации, изучении свойств, модификации нужных генов и создании эффективных систем их экспрессии в клетках микроорганизмов, которые можно будет использовать для промышленного синтеза соответствующего продукта, а задача биотехнологов — в обеспечении условий оптимального роста нужного рекомбинантного микроорганизма с целью получения продукта с наибольшим выходом. На заре развития молекулярной биотехнологии ученые наивно полагали, что переход от лабораторного синтеза к промышленному — это вопрос простого увеличения масштаба, т. е. условия, оптимальные для малых объемов, будут оптимальными и для больших, так что достаточно просто взять больший реактор и соответственно больший объем культуральной среды.
Такое упрощенное представление не соответствует действительности. Например, аэробные микроорганизмы хорошо растут в обычной колбе на 200 мл при аэрации ее содержимого с помощью мешалки мощностью 300 Вт. Если просто увеличить объем «колбы» до 10 000 литров, то потребуется мешалка мощностью 15 МВт. Ее мотор будет размером с дом, а при перемешивании выделится столько тепла, что микроорганизмы попросту сварятся. Этот простой пример может не во всем убедить биотехнологов, однако они точно знают, что проблема промышленного культивирования микроорганизмов не сводится к пропорциональному увеличению масштаба лабораторного эксперимента. Конечно, увеличить размер реактора (биореактора, ферментера) совершенно необходимо, поскольку для получения 10 000 л клеточной суспензии не имеет смысла использовать 50 000 отдельных колб на 200 мл. Однако помимо этого для получения максимального выхода как в малых (от 1 до 10 л), так и в больших (>1000 л) биореакторах необходимо оптимизировать множество параметров: температуру, pH, интенсивность и способ перемешивания культуры и — в случае аэробных организмов — концентрацию кислорода. При этом надо иметь в виду, что как правило оптимальные условия изменяются при каждом десятикратном увеличении объема биореактора.
Есть и другие очень важные соображения. В реакторе должен поддерживаться достаточный уровень стерильности и, кроме того, необходимо создать условия, предотвращающие утечку генетически измененных микроорганизмов. Чтобы иметь возможность быстро и легко изменять условия в ходе ферментации, реактор должен быть снабжен контрольно-измерительной аппаратурой, позволяющей непрерывно отслеживать значения как можно большего числа параметров. Поскольку при стерилизации может изменяться состав среды (например, могут разрушаться витамины), важно убедиться в том, что он остался оптимальным для роста нужных микроорганизмов.
Как правило, промышленная ферментация и очистка продукта — процессы многоступенчатые (рис, 16,1). Обычно процедура начинается с приготовления и стерилизации культуральной среды и оборудования. Сначала выращивают исходную культуру (5—10мл), затем инкубируют ее во встряхиваемой колбе (200—1000 мл), после
350ГЛАВА 16
чего переносят в ферментер для посевного материала (10—100 л) и, наконец, в промышленный ферментер (1000—100 000 л). По завершении ферментации клетки выделяют из культуральной среды центрифугированием или фильтрацией. Если продукт локализован внутри клеток, последние разрушают, удаляют клеточные осколки и выделяют продукт из осветленной среды, Секретируемый продукт выделяют непосредственно из среды.
Рост микроорганизмов
Микроорганизмы можно выращивать в ферментере периодического действия, в ферментере периодического действия с добавлением субстрата
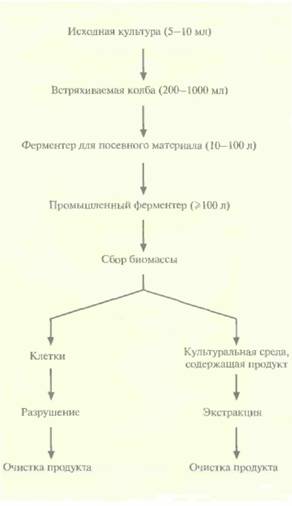 | Рис. 16.1. Обобщенная схема процесса промышленной ферментации. Выделяемый продукт находится либо в клетках, либо в культуральной среде, но не в обеих фракциях одновременно, так что дальнейшие манипуляции проводят с одной из этих фракций. |
или в непрерывной культуре (рис. 16.2). В первом случае микроорганизмы выращивают в стерильных условиях без добавления в ходе ферментации свежей культуральной среды. Во втором случае по ходу ферментации к культуре периодически добавляют увеличивающиеся количества питательных веществ, при этом культуральную среду не удаляют до окончания процесса. При непрерывной ферментации свежая культуральная среда поступает в ферментер непрерывно, и параллельно отводится такой же объем клеточной суспензии. Во всех случаях через среду при необходимости продувают кислород (обычно в виде стерильного воздуха), добавляют пеногаситель и (если это нужно) кислоту или основание.
Промышленный синтез белков приучастии рекомбинантных микроорганизмов 351
 |
| Рис. 16.2. Изменение во времени концентрации клеток и субстрата в периодической культуре (А), периодической культуре с добавлением субстрата (Б) и в непрерывной культуре (В). |
Периодическая культура
В ходе периодической ферментации состав культуральной среды, концентрация микроорганизмов (концентрация биомассы), химический состав клеток и количество белкового продукта или метаболита зависят от фазы роста, клеточного метаболизма и наличия питательных веществ. Различают шесть основных фаз роста: лаг-фазу, фазу ускорения, логарифмическую (log), или экспоненциальную фазу, фазу замедления, стационарную фазу и фазу отмирания (рис. 16.3).
Обычно после инокуляции стерильной культуральной среды мгновенного увеличения числа клеток не наблюдается. В течение какого-то периода времени, называемого лаг-фазой, клетки адаптируются к новым условиям: другим pH или концентрации питательных веществ, В ходе такой адаптации может произойти включение каких-то новых, ранее не проявившихся путей метаболизма. Лаг-фаза наблюдается всякий раз, когда посевной материал получен из культуры, рост которой прекратился n результате исчерпания субстрата или ингибирования продуктом (т. е. культуры в стационарной фазе). Продолжительность лаг-фазы зависит от времени, в течение которого клетки посевного материала находились в стационарной фазе, и от того, как сильно различались среда, в которой росла культура, и новая, свежая культуральная среда. Если же посевным материалом служит культура, находящаяся в экспоненциальной фазе, то выраженная лаг-фаза может отсутствовать и рост начнется немедленно после инокуляции. Между лаг- и экспоненциальной фазами есть короткий период, так называемая фаза ускорения, когда скорость роста клеток увеличивается до достижения постоянной величины.
Во время экспоненциальной фазы клетки претерпевают несколько делений, а удельная скорость роста остается постоянной. При из-
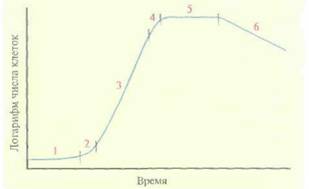 |
| Рис. 16.3. Кривая роста бактериальной культуры при периодической ферментации. 1 - лаг-фаза, 2 - фаза ускорения, 3 - экспоненциальная фаза, 4 - фаза замедления, 5 - стационарная фаза, 6 - фаза отмирания. |
352ГЛАВА 16
бытке субстрата (питательных веществ) и в отсутствие ингибирования роста каким-либо соединением, присутствующим в культуральной среде, удельная скорость роста не зависит от концентрации субстрата. Кривую роста при таких условиях можно описать математически, что позволяет биотехнологам моделировать процесс, а затем провести его масштабирование. Прирост клеточной массы во времени dX/dt равен произведению удельной скорости роста μ на биомассу X:
dX/dt= μΧ.
Аналогично, прирост числа клеток dN/dt равен произведению удельной скорости μ на число клеток Ν:
dN/dt =μΝ.
Удельная скорость μ зависит от концентрации лимитирующего субстрата (источника углерода или азота) S, максимальной удельной скорости роста μmах и субстратспецифичной константы Ks:
μ = μmахS/(KS+S).
И S, и KS имеют размерность концентрации (г/л или М).
Иногда вместо удельной скорости роста используют время удвоения, или время генерации  . Это время, зa которое в определенных условиях число клеток или биомасса удваивается. Для одноклеточных микроорганизмов вели-чина μmах обычно находится в диапазоне от 2,1 до 0,086 ч-1, что соответствует времени удвоения примерно от 20 мин до 8 ч.
. Это время, зa которое в определенных условиях число клеток или биомасса удваивается. Для одноклеточных микроорганизмов вели-чина μmах обычно находится в диапазоне от 2,1 до 0,086 ч-1, что соответствует времени удвоения примерно от 20 мин до 8 ч.
Когда субстрат присутствует в избытке (т. е. при  и достигается максимальная скорость роста культуры в экспоненциальной фазе. Как правило, величина Ks настолько мала, что концентрация субстрата редко становится сравнимой с Ks во время экспоненциальной фазы. Например, в случае Escherichia coli Ks для глюкозы равна примерно 1 мг/л, а начальная концентрация глюкозы в среде обычно составляет около 10 000 мг/л. Однако в конце экспоненциальной фазы субстрата остается мало, и S может стать ниже Ks. При S < Ks быстро наступает фаза замедления. Она может быть очень кратковременной или даже практически незаметной, поскольку из-за большого числа клеток в конце экспоненциальной фазы субстрат может быть израсходован очень быстро.
и достигается максимальная скорость роста культуры в экспоненциальной фазе. Как правило, величина Ks настолько мала, что концентрация субстрата редко становится сравнимой с Ks во время экспоненциальной фазы. Например, в случае Escherichia coli Ks для глюкозы равна примерно 1 мг/л, а начальная концентрация глюкозы в среде обычно составляет около 10 000 мг/л. Однако в конце экспоненциальной фазы субстрата остается мало, и S может стать ниже Ks. При S < Ks быстро наступает фаза замедления. Она может быть очень кратковременной или даже практически незаметной, поскольку из-за большого числа клеток в конце экспоненциальной фазы субстрат может быть израсходован очень быстро.
В результате истощения лимитирующего субстрата (например, источника углерода) или накопления продуктов метаболизма, замедляющих рост, увеличение числа клеток постепенно прекращается и культура переходит в стационарную фазу. В это время биомасса остается постоянной, однако метаболизм часто претерпевает кардинальные изменения. Именно в этот период нередко синтезируются соединения (вторичные метаболиты), представляющие коммерческий интерес, например антибиотики. Продолжительность стационарной фазы зависит от конкретного организма и условий роста.
В фазе отмирания энергетические запасы клеток оказываются исчерпанными, и метаболизм прекращается. В большинстве промышленных процессов ферментацию останавливают и клетки собирают еще до наступления фазы отмирания.
Периодическая культура с добавлением субстрата
В этом случае в ферментер периодически добавляют субстрат, а конечный продукт собирают только по завершении процесса. Добавление субстрата приводит к удлинению экспоненциальной и стационарной фаз и к увеличению биомассы и количества метаболитов, синтезируемых во время стационарной фазы (например, антибиотиков). Однако в стационарной фазе микроорганизмы часто синтезируют протеолитические ферменты (протеиназы), разрушающие все производимые ими белки. Поэтому, если целью ферментации является получение белковых продуктов, нужно остановить процесс до его перехода в эту фазу. Прямое измерение концентрации субстрата в ходе ферментации часто бывает затруднено, и чтобы определить, в какой момент нужно добавить следующую порцию субстрата, приходится использовать другие показатели, коррелирующие с его расходованием, например количество синтезированных органических кислот, значение pH или количество образовавшегося СО2. Вообще говоря, ферментеры периодического действия с добавлением субстрата требуют постоянного и более тщатель-
Промышленный синтез белков при участии рекомбинантныхмикроорганизмов 353
ного контроля, чем простые ферментеры периодического действия, и поэтому используются реже. Но они имеют ряд преимуществ, если говорить о разработке систем получения белков с помощью рекомбинантных микроорганизмов, а потому становятся все более популярными.
Периодическое добавление субстрата к растущей культуре рекомбинантных микроорганизмов продлевает экспоненциальную фазу и отсрочивает наступление стационарной фазы, во время которой инициируются клеточные ответы на стрессовые воздействия, происходит синтез протеиназ и другие изменения метаболизма, уменьшающие выход рекомбинантного белка. Для поддержания метаболизма клетки-хозяина количество добавляемого субстрата необходимо постоянно увеличивать. Чтобы обеспечить непрерывный синтез рекомбинантного белка и его стабильность, нужно тщательно контролировать процесс и добавлять субстрат (источник углерода и азота вместе с микроэлементами) сразу, как только в этом возникнет необхолмость. В завпсимости от генотипа микроорганизма и природы рекомбинантного белка при периодической ферментации с добавлением субстрата выход продукта может возрасти на 25—1000 % по сравнению с простой периодической ферментацией.
Периодическую ферментацию с добавлением субстрата можно использовать для культивирования не только микроорганизмов, но и клеток млекопитающих и насекомых. Это очень важно, поскольку: ]) такие культуры все шире применяются для получения белковых продуктов, имеющих медицинское значение; 2) без периодического добавления субстрата животные клетки не очень эффективно синтезируют чужеродные белки.
Непрерывная культура
При непрерывной ферментации стационарные условия, т, е. условия, при которых dX/dt = 0, обеспечиваются тем, что при постоянном объеме биореактора убыль числа клеток (удаление продукта) в точности уравновешивается их увеличением в результате деления. Говоря более формальным языком, для непрерывного процесса в стационарном состоянии скорость разведения D, определяемая как скорость притока
среды F, деленная на постоянный объем среды V в биореакторе,
D= F/V,
равна удельной скорости роста μ: D=(dX/dt)(1/X)= μ.
Чтобы получить непрерывную культуру с постоянными гидродинамическими характеристиками, нужно создать условия, при которых удельная скорость роста была бы ниже максимальной величины µmax. Для этого нужно так отрегулировать насос, который контролирует скорость притока F, чтобы объем культуры в биореакторе V поддерживался постоянным.
Важнейшей задачей промышленной ферментации является получение максимального количества продукта при минимуме затрат. Эту задачу можно решить, если для каждого конкретного процесса разрабатывать свою, наиболее эффективную конструкцию ферментера. Вообще говоря, непрерывная ферментация применяется в промышленных целях не так уж часто, прежде всего потому, что ученые накопили наибольший , опыт в работе с периодическими культурами. При этом стоимость получения данного количества биомассы в ферментере непрерывного действия гораздо ниже, чем в ферментере, работающем в периодическом режиме. Такое удешевление обусловливается следующими факторами.
• Для получения данного количества продукта с помощью непрерывной ферментации нужны меньшие биореакторы, чем с помощью периодической.
• При периодической ферментации для сбора клеток, их разрушения и последующей очистки белкового продукта или метаболита, синтезированного микроорганизмом, необходимо крупногабаритное оборудование. В то же время в ферментере непрерывного действия синтез идет постепенно, так что и оборудование может быть не столь громоздким.
• Ферментер, работающий в непрерывном режиме, не простаивает, как ферментер, периодического действия, который нужно время от времени разгружать и подготавливать к повторному использованию. Простой биоре-
354 ГЛАВА 16
актора в связи с ремонтом, чисткой или стерилизацией — основная причина снижения эффективности процесса. При непрерывной ферментации этот простой гораздо меньше.
• Физиологический статус большинства клеток при непрерывной ферментации одинаков, поэтому синтез происходит более согласованно. При периодической же ферментации небольшие различия во времени сбора клеток, который проводят начиная с середины экспоненциальной фазы и заканчивая ее поздним этапом, могут приводить к значительной рассогласованности.
Непрерывную ферментацию уже использовали для промышленного получения белков одноклеточных микроорганизмов, антибиотиков и органических растворителей.
Впрочем, этот способ имеет и свои недостатки.
• Время ферментации в непрерывном режиме иногда составляет 500—1000 ч, при этом некоторые клетки могут потерять рекомбинантные плазмиды. Клетки, не несущие плазмид, обычно расходуют меньше энергии и делятся быстрее, чем те, которые содержат плазмиду, поэтому со временем выход продукта может снижаться из-за уменьшения числа клеток, способных его синтезировать. Эту проблему можно было бы решить, интегрировав клонированный ген в геном организма хозяина.
• Очень трудно поддерживать стерильные условия в промышленных установках в течение долгого времени. Кроме того, для непрерывных процессов необходимо стерильное резервное оборудование, что значительно увеличивает основные затраты.
• К качеству компонентов культуральной среды, используемой при крупномасштабной ферментации, не предъявляются столь высокие требования, как к компонентам среды при ферментации в лабораторных условиях; они могут изменяться от одного процесса к другому, что может приводить к изменению физиологии клеток и снижению производительности.
Репутация периодической ферментации как весьма надежной системы сдерживает переход к любому другому типу ферментации, даже при том что непрерывный режим работы более эффективен. И все-таки недавно было создано сразу несколько установок, лабораторных (до 10 л) и пилотных (до 1000 л), для непрерывной и периодической ферментации с добавлением субстрата — с целью получения белков с помощью рекомбинантных микроорганизмов. Это говорит о том, что более широкое применение непрерывных ферментеров и периодических ферментеров с добавлением субстрата в промышленности -это только вопрос времени.
Повышение эффективности ферментации
Независимо от типа биореактора в ходе ферментации необходимо строго контролировать такие параметры, как концентрация растворенного кислорода, pH, температура и интенсивность перемешивания. Слишком сильное изменение любого из них может существенно снизить скорость роста клеток и стабильность белкового продукта.
Для оптимального роста Е. coli и многих других микроорганизмов, используемых в качестве инструмента экспрессии рекомбинантных белков, обычно нужна хорошо аэрируемая культуральная среда. Максимальная скорость утилизации кислорода при ферментации Qmax зависит от массы клеток X, максимальной удельной скорости роста mах и скорости роста, зависящей от количества потребленного кислорода  . Эта зависимость выражается следующей формулой:
. Эта зависимость выражается следующей формулой:
Qmax = Xµmax/YO2.
Поскольку кислород плохо растворим в воде (0,0084 г/л при 25 °С), он должен подаваться в среду непрерывно. Обычно для аэрации через ферментер продували стерилизованный воздух. Однако при этом в среде образуются пузырьки, и если они слишком велики, то скорость переноса кислорода к клеткам недостаточна для поддержания их роста. Таким образом, в ходе ферментации необходимо с помощью специального датчика контролировать содержание растворенного кислорода в среде, следить за его равно-
Промышленный синтез белков при участии рекомбинантных микроорганизмов 355
 |
| Экспрессия гена гемоглобина стимулирует синтез белка в Е. соli в условиях недостатка кислорода |
| С. Khosla, J.E. Curtis, J. DeModena, U.Rinas, J.E. Bailey Bio/Technology 8:849-853. 1990 |
| Поскольку кислород плохо растворим в воде, рост аэробных бактерий часто лимитируется количеством растворенного в культуральной среде кислорода. Эта проблема особенно актуальна при большой плотности культуры или при крупномасштабной ферментации. Чтобы решить ее, биотехнологи попытались увеличить количество кислорода, поступающего в жидкую кулыуральную среду. Предложенные подходы состояли в следующем: 1) подача в кулыуральную среду чистого кислорода вместо воздуха; 2) подача воздуха (или кислорода) под давлением; 3) добавление к культуральной среде хими- | ческих соединений, таких как перфторуглероды, повышающие растворимость кислорода; 4) модификация конструкции ферментера таким образом, чтобы обеспечивались оптимальная аэрация и перемешивание культуральной среды. Все эти подходы решают «кислородную проблему" лишь частично. Для каждого из них существует свой порог, по достижении которого выход продукта уже нельзя повысить дальнейшим добавлением кислорода. В качестве альтернативы Бейли и др. предложили модифицировать микроорганизм, использующийся для культивирования, | таким образом, чтобы он мог более эффективно использовать тот кислород, который присутствует в культуральной среде. Они перенесли ген, кодирующий гемоглоби-ноподобное соединение, из грамотрицательной бактерии Vitreoscilla sp. в несколько рекомбинантных бактерий. Бактериальный гемоглобин связывал кислород среды и поддерживал высокую концентрацию его в клетках, что стимулировало рост и экспрессию чужеродного белка. Этот подход проиллюстрировал возможность весьма неожиданного биологического решения трудной технической задачи. |
мерным распределением по всему объему и тщательным перемешиванием культуры, обеспечивающим эффективное диспергирование пузырьков.
Большинство микроорганизмов растут лучше всего при pH от 5,5 до 8,5. Следует иметь в виду, однако, что клеточные метаболиты, поступая в культуральную среду, могут изменять ее pH. Таким образом, необходимо тщательно контролировать pH в ходе ферментации и при необходимости добавлять в ферментер кислоту или щелочь. При этом последние должны быть хорошо перемешаны со средой и равномерно распределены по всему объему.
Еще один параметр, от которого зависит успех ферментации, — температура. Если она ниже оптимальной, то рост микроорганизмов замедляется и интенсивность метаболизма снижается. Если же, напротив, температура слишком высока, то может произойти преждевременная индукция синтеза белка, если он находится под контролем температурочувствительного репрессора, или индукция белков теплового шока, что активизирует клеточные протеиназы и снизит выход белкового продукта.
Тщательное перемешивание культуры необходимо, во-первых, для равномерной доставки питательных веществ к клеткам и, во-вторых, для предотвращения накопления токсичных побочных продуктов метаболизма в каком-нибудь небольшом отсеке биореактора. Эффективное перемешивание относительно легко обеспечить при культивировании в небольших объемах, при крупномасштабном же культивировании поддержание гомогенности культуральной среды становится одной из главных проблем.
Перемешивание культуральной среды влияет и на другие параметры: скорость переноса кислорода из пузырьков газа в жидкую среду, а затем из среды в клетки; эффективность теплопередачи; точность измерения концентрации метаболитов в культуральной жидкости; эффективность диспергирования добавляемых реагентов (кислот, оснований, питательных веществ и т. д.). Исходя из всего этого, можно было бы предположить, что чем интенсивнее культура перемешивается, тем лучше она растет. Однако при чрезмерном перемешивании среды в ней могут возникнуть гидромеханические эффекты, губительные для бактериальных клеток и клеток
356ГЛАВА 16
млекопитающих, или произойти повышение температуры, которое также скажется на их жизнеспособности. Таким образом, как всегда, нужно соблюдать баланс между необходимостью тщательно перемешивать среду и стремлением сохранить целостность клеток.
Есть еще один аспект, касающийся крупномасштабной ферментации, который не имеет отношения к технической стороне процесса, а касается того, используются ли при этом реком-бинантные микроорганизмы. В большинстве стран крупномасштабное культивирование ре-комбинантных микроорганизмов сопряжено с необходимостью соблюдения определенных правил и инструкций. Хотя большинство рекомби-нантных микроорганизмов не представляют никакой опасности, важно не допустить их случайного попадания в среду. Для этого используются надежные системы, предотвращающие утечку живых рекомбинантных организмов или ограничивающие их распространение, если утечка все же произошла. Кроме того, перед окончательным удалением из установки все рекомби-нантные микроорганизмы должны быть инактивированы в соответствии с определенными инструкциями. Использованную культураль-ную среду тоже необходимо проверять на наличие в ней жизнеспособных микроорганизмов, чтобы исключить их попадание в окружающую среду.
Культуры с высокой плотностью
Вообще говоря, при получении чужеродных белков с помощью рекомбинантных E. coti руководствуются тем, что при максимальной конечной плотности культуры получается и максимальное количество продукта. В ферментерах периодического действия с добавлением субстрата концентрация рекомбинантных клеток E. coli достигает 50 грамм сухого вещества на 1 л среды (а в некоторых случаях >100 г/л), (Вес сухого вещества клеток Е. coli составляет примерно 20—25% веса влажного вещества.)
Один из способов повышения плотности культуры состоит в оптимизации культуральной среды. Следует иметь в виду, что некоторые питательные вещества, в том числе источники углерода и азота, при слишком больших концентрациях замедляют рост клеток. Глюкоза подавляет рост при концентрации >50 г/л, аммиак — при концентрации >3 г/л, железо -->1,15 г/л, магний -- >8,7 г/л, фосфор — >10 г/л, цинк — >0,038 г/л. Таким образом, простое увеличение содержания питательных веществ в культуральной среде при периодической ферментации не даст желаемого результата. Кроме того, поскольку состав сложных сред типа пептона или дрожжевого экстракта может немного различаться от раза к разу, ферментация в них не всегда бывает воспроизводимой.
Ацетат, который может подавлять рост клеток, продуцируется Е. coli при росте в условиях недостатка кислорода, но избытка глюкозы. Проблему его образования можно решить, если использовать в качестве источника углерода глицерин вместо глюкозы, понизить температуру или использовать рекомбинантный штамм E. coli, способный превращать ацетат в менее токсичные вещества (см. гл. 6).
В культурах с высокой плотностью может также возникнуть недостаток кислорода. Чтобы избежать этого, увеличивают количество поступающего воздуха (разбрызгивание) либо скорость перемешивания или делают и то, и другое. Кроме того, можно подавать в культуру чистый кислород, а не воздух, в котором содержится только 20% кислорода, или выращивать клетки под давлением, чтобы увеличить растворимость кислорода, В качестве альтернативы предлагалось экспрессировать в хозяйских клетках E. coti ген гемоглобина Vitreoscilla, что значительно увеличило бы поглощение кислорода растущими клетками.
Высокой плотности чаше всего удается достичь при росте в периодическом режиме с добавлением субстрата. Режим подачи питательных веществ может быть разным: непрерывным, ступенчатым или экспоненциальным. При непрерывном режиме в среду в течение всей ферментации вносят одинаковые количества питательных веществ. Однако в этих условиях удельная скорость роста непрерывно снижается. При ступенчатом режиме питательные вещества добавляют по мере увеличения концентрации клеток во все большем количестве, так что снижение удельной скорости роста в значительной мере компенсируется. При экспоненциальном режиме питательные вещества добавляют в количестве, обеспечивающем постоянную скорость роста клеток. Периодическую подачу питательных веществ можно автоматизи-
Промышленный синтез белков при участии рекомбинантных микроорганизмов 357
ровать, основываясь на результатах измерения концентрации лимитирующего субстрата (например, глюкозы) в среде в ходе ферментации.
Биореакторы
При беглом просмотре литературы по биотехнологии создается впечатление, что число типов биореакторов безгранично. Однако на самом деле все биореакторы можно подразделить на три основных группы:
• реакторы с механическим перемешиванием (рис. 16А, А)
• барботажные колонны, через которые для перемешивания содержимого пропускается воздух или другой газ (рис. 16.4, Б)
• эрлифтные реакторы с внутренней (рис. 16.4, В) или внешней (рис. 16.4, Г) рециркуляцией; перемешивание и циркуляция культуральной среды в них обеспечивается потоком газа (обычно воздуха), за счет которого между верхним и нижним слоями культуральной среды возникает градиент плотности.
Чаще всего используются биореакторы первого типа. Они обладают следующими преимуществами:
• позволяют легко менять технологические условия
• всегда есть в продаже
• обеспечивают эффективную доставку газа к растущим клеткам (если говорить на инже-
| Рис. 16.4. Разные типы биореакторов (упрощенная схема), А. Реактор с механическим перемешиванием . Б. Барботажная колонна. В. Эрлифтный реактор с внутренней рециркуляцией. Г. Эрлифтный реактор с внешней системой рециркуляции. Стрелки -- направление потока культуральной среды. |  |
358 ГЛАВА 16
нерном языке, обладают высоким объемным коэффициентом массообмена, kLa) • уже давно используются для выращивания различных микроорганизмов.
В реакторах с механическим перемешиванием газ (как правило, воздух) подают в культуральную среду под давлением через разбрызгиватель - - кольцо с множеством маленьких отверстий либо трубку с одним отверстием. В первом случае образуются мелкие пузырьки воздуха и обеспечивается их более равномерное распределение, однако разбрызгиватели в виде трубок используются чаще, поскольку они реже закупориваются. Для равномерного распределения газа по всему объему биореактора используются мешалки — одна или несколько. Они разбивают крупные пузырьки воздуха, разносят их по всему реактору и увеличивают время пребывания в культуральной среде. При сильном перемешивании средний размер пузырьков в больших биореакторах практически не зависит от размера отверстий в разбрызгивателе. Эффективность распределения газа зависит прежде всего от типа мешалки, числа оборотов и физико-химических свойств среды. Если размер биореактора слишком велик, а газ, поступающий из разбрызгивателя, распределяется по объему неравномерно, то даже при энергичном перемешивании гомогенизировать среду не удается.
Многие культуральные среды весьма агрессивны, и во избежание коррозийного или механического повреждения стенок биореактора его обычно изготавливают из нержавеющей стали или стекла. Стеклянные части чаще используют только в лабораторных биореакторах емкостью меньше 50 л.
Размер биореактора лимитируется его способностью эффективно отдавать тепло, выделяемое микроорганизмами в ходе метаболизма и высвобождаемое в результате перемешивания. Если теплоотдача недостаточна, температура среды может превысить критическую, что уменьшит выход продукта. Для отвода тепла используют охлаждающую рубашку или змеевики, помещаемые внутрь реактора. Внутреннее охлаждение более эффективно, однако змеевики часто покрываются слоем растущих клеток, что затрудняет охлаждение, а иногда мешает интенсивному перемешиванию культуральной среды.
Большую опасность представляет загрязнение ферментера грибами или бактериями. Поэтому биореакторы конструируют таким образом, чтобы их можно было стерилизовать; обычно для этого используют пар под давлением. Внутри реактора не должно быть «мертвых зон», недоступных для пара во время стерилизации. Обработке подлежат все клапаны, датчики, входные и выходные отверстия. При конструировании перед инженерами зачастую возникает проблема: использовать максимальное число датчиков для полного контроля за процессом ферментации или ограничиться их минимальным набором, чтобы легче было поддерживать стерильность.
