Схема 45. Основные законы и принципы учения о химических процессах
v Закон действующих масс. Скорость химических реакций при постоянной температуре пропорциональна произведению концентраций реагирующих веществ:  |
v Правило Вант-Гоффа. при повышении температуры на 10º скорость гомогенной реакции возрастает в γ раз:  |
| v Принцип Ле-Шателье. Определяет подвижное равновесие. Химическим равновесием называется состояние, в котором скорость обратной реакции равна скорости прямой реакции. |
v Закон Аррениуса. Доля атомов (молекул), способных прореагировать: 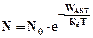 |
Особое значение в учении о химических процессах приобрел закон С. Аррениуса. Закон сохранения энергии не позволяет всем реагентам (молекулам) соединиться друг с другом; существует некоторый энергетический барьер (определяемый количеством связей, порядком расположения атомов), только преодолев который, вещества вступят в реакцию. С. Аррениус доказал, что в реакцию могут вступать только те молекулы (реагенты), которые обладают избыточной энергией, т.е. активные молекулы. При обычной температуре их доля увеличивается в соответствии с правилом Вант-Гоффа.
В XX веке особую роль приобрела физическая химия цепных химических реакций: большинство реакций идет не прямо, а через промежуточные продукты, потому что при этом значительно понижается энергия активации. Она уменьшается особенно заметно, если атомы или соединения, входящие в промежуточные реакции, имеют свободные, ненасыщенные валентности. Такие атомы и соединения называются радикалами. Их обычно обозначают точкой над химическим символом. Академик Н.Н.Семенов открыл в 1926-1932гг класс цепных реакций, где взамен одной свободной валентности (радикала) получается несколько свободных валентностей (радикалов). В 1956г за эти работы ему была присуждена Нобелевская премия по химии. Особую роль в учении о химических процессах приобрел катализ, который позволил перебросить мостик от классической к неклассической (квантовой) химии и эволюционной химии. Оказалось, что условия протекания химических процессов в современной химии становятся зависимыми не только от термодинамических (температуры, давления и т.п.), но и структурно-кинетических факторов: строения исходных реагентов; их концентрации; наличия в реакторе катализаторов (или ингибиторов) и других добавок; способов смешивания реагентов, материалов и конструкции реактора и т.п. Влияние такого типа факторов, воздействие которых зачастую носит неконтролируемый характер, может быть сведено к катализу.
В рамках концепции неконтролируемого воздействия в химии основные понятия катализа представим в табличном виде (см. схему 46). При этом химия все более учитывает вероятностный подход квантовой физики, а также законы и принципы как равновесной, так и неравновесной необратимой термодинамики.
Катализ определяет положительное воздействие на химический процесс, а ингибирование определяет сдерживающий процесс.
Схема 46. Основные понятия (определения) катализа.
| v Катализ - ускорение химической реакции в присутствии веществ – катализаторов, которые взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав конечного продукта. |
| v Гомогенный катализ - катализ, который происходит либо в газовой смеси, либо в растворе, в котором растворены как катализатор, так и реагенты. |
| v Гетерогенный катализ - катализ, при котором химическая реакция совершается в поверхностных слоях на границе раздела твердого тела, который обычно и выполняет роль катализатора, и газообразной или жидкой смеси реагентов. |
| v Ферментный катализ - катализ, в котором в качестве катализаторов используются ферменты, как природные, так и искусственные сложнейшие молекулярные системы - биологические катализаторы. |
| v Автокатализ - катализ, в котором в качестве катализатора выступают те или иные продукты химической реакции. |
Катализ играет решающую роль в процессе перехода от химических систем к биологическим.
Эволюционная химия
Предметом эволюционной химии является самоорганизация предбиологических систем. Существует два подхода к проблеме самоорганизации предбиологических систем: субстратный и функциональный.
Субстратный подход.
Отличительная черта субстратного подхода состоит в исследовании вещественной основы биологических систем, т.е. определённого состава элементов – органогенов и определённой структуры входящих в живой организм химических соединений. Результатом субстратного подхода к проблеме биогенеза является накопленная информация об отборе химических элементов и структур.
Отбор химических элементов в процессе самоорганизации предбиологических систем внёс определённые закономерности в этот процесс:
Основу живых систем составляют только шесть элементов, получивших название органогенов: углерод, водород, кислород, азот, фосфор, сера, общая весовая доля которых в организме составляет более 97%. За ними следует 11 элементов, которые принимают участие в построении многих физиологически важных компонентов биосистем: натрий, калий, кальций, магний, железо, кремний, алюминий, хлор, медь, цинк, кобальт. Их весовая доля в организме - 1,6%. Есть ещё 20 элементов, участвующих в построении и функционировании отдельных узкоспецифических биосистем, доля которых составляет около 1%. Участие всех остальных элементов в построении биосистем практически не зафиксировано.
Картина химического мира свидетельствует об отборе элементов. В настоящее время насчитывается около 8 млн. химических соединений из них 96% - органические, состоящие из тех же 6 -18 элементов. Интересно, что природа создала всего около 300 тыс. неорганических соединений.
Геохимические условия не играют существенной роли в отборе химических элементов при формировании органических и биологических систем. Определяющим фактором в отборе химических элементов в данном случае выступают условия соответствия этих элементов определённым требованиям: а) способность образовывать прочные и энергоёмкие химические связи; б) эти связи должны быть лабильны, т. е. легко подвергающиеся гомолизу, гетеролизу или циклическому перераспределению. Вот почему углерод, обладающий этими свойствами, отобран из многих других элементов как органоген № 1.
Функциональный подход
Отличительная черта функционального подхода состоит в исследовании процессов самоорганизации предбиологических систем, выявлении законов, которым подчиняются такие процессы.
Теория саморазвития элементарных каталитических систем в самом общем виде является общей теорией химической эволюции и биогенеза. Основы данной теории были разработаны А.П. Руденко в 1964 г.
Под эволюционными проблемами в химии понимают процессы самопроизвольного синтеза новых химических соединений, являющихся более сложными и высокоорганизованными продуктами по сравнению с исходными веществами. Поэтому эволюционную химию считают предтечей биологии – наукой о самоорганизации и о саморазвитии химических систем.
В физико-химическом образе неклассической биологии все функции и процессы, происходящие в живом организме, можно изложить на языке физики и химии в виде конкретных физико-химических процессов.
Основой исключительной эффективности биологических процессов является биосинтез. Поэтому новая химия должна основываться на каталитическом опыте живой природы.
Для освоения каталитического опыта живой природы перспективным направлением являются исследования, ориентированные на применение принципов биокатализа в химии и химической технологии, что предполагает изучение закономерностей живой природы, в том числе и опыта формирования фермента, клетки, организма. Здесь и заложены основы эволюционной химии, предполагающей пути новых химических технологий, способных стать аналогами живых систем.
Эволюционная химия – это новое управление химическими процессами, предполагающее применение принципов синтеза себе подобных молекул. По принципу ферментов создадутся катализаторы с таким разнообразием качеств, которые далеко превзойдут катализаторы, существующие в химической промышленности.
Возникновению эволюционной химии способствовали исследования в области моделирования биокатализаторов и реально ощутимые успехи «нестационарной кинетики» или динамики химических систем.
Ведущее положение в развитии нестационарной кинетики занимает теория саморазвития открытых каталитических систем, способствующая существенному улучшению свойств катализаторов.
Саморазвитие, самоорганизация, самоусложнение происходят за счет естественного отбора активных каталитических центров и постоянного притока трансформируемой энергии. Поскольку источником энергии в основном является базисная реакция, то эволюционное преимущество получают каталитические системы, протекающие на основе экзотермических реакций. Отсюда базисная реакция является источником энергии, средством отбора прогрессивных эволюционных изменений катализаторов.
Теория саморазвития элементарных каталитических систем в самом общем виде является общей теорией химической эволюции и биогенеза. Основы данной теории были разработаны А.П. Руденко в 1964 г.
Суть данной теории – химическая эволюция есть не что иное, как саморазвитие каталитических систем. Эволюционирующим доминантам являются катализаторы.
Перспектива развития новой химии – это создание малоотходных, безотходных и энергосберегающих промышленных технологий.
Основные проблемы данной теории – это вопросы о движущих силах и механизмах эволюционного процесса, т.е. вопросы выявления и определения основных закономерностей химической эволюции, отбора элементов и структур, уровня химической организации и иерархии химических систем как следствия эволюции.
Важным результатом открытия цикличности химических процессов и в общем понимании цикла, как основы мироздания, было обнаружение и исследование различных химических автоколебательных и автоволновых процессов типа реакции Белоусова-Жаботинского.
Проблема биологической эволюции непосредственным образом связана с проблемой химической самоорганизации (и химической эволюции). Одна из задач химии, а именно самого новейшего ее направления – эволюционной химии, понять, как из неорганической материи возникает жизнь. Поэтому эволюционную химию можно назвать «предбиологией».
«Подражание живой природе есть химия будущего!» Этот девиз, который был высказан академиком А.Е.Арбузовым в 1930 г., является целеполагающей идеей развития эволюционной концепции в химии.
Литература.
1. Наследников Ю.М. Концепции современного естествознания/ Ю.М.Наследников, А.Я.Шполянский, А.П.Кудря, А.Г.Стибаев.-Ростов-на-Дону: ДГТУ 2008-350с. [электронный ресурс № ГР 15393,2010]. Режим доступа: http://de.dstu.edu.ru/., с. 190-210
2. Наследников Ю.М. Концепции современного естествознания: Учеб.-метод. пособие/ Ю.М. Наследников, А.Я. Шполянский, А.П. Кудря, А.Г. Стибаев.- Ростов-на-Дону: ДГТУ, 2007, с. 63-68
3. Суханов А.Д. Концепции современного естествознания: Учебник для вузов/А.Д. Суханов, О.Н. Голубева.- М.: Дрофа, 2004. с. 147-151
4. Горбачев В.В. Концепции современного естествознания. Интернет-тестирование базовых знаний: Учебное пособие/ В.В. Горбачев, Н.П. Калашников, Н.М. Кожевников.- СПб.: Издательство «Лань»,2010, с. 77-86.
