Изменение энтальпии в различных химических и физико-химических процессах.
Обычно энтальпии образования имеют абсолютные значения от (±) сотен до нескольких тысяч кДж/моль. Стандартные значения энтальпий сгорания органических веществ имеют отрицательные значения. Фазовые переходы, при которых простое или сложное вещество переходит из одной твердой модификации в другую, обычно сопровождаются энергетическими эффектами порядка десятых долей единиц или нескольких десятков кДж/моль.
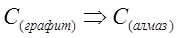 ;
; 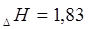 кДж/моль
кДж/моль
Любой человеческий организм является открытой термодинамической
системой. Основным источником энергии для него является химическая энергия, заключенная в пищевых продуктах, часть которой расходуется на:
1. совершение работы внутри организма, связанной с дыханием,
кровообращением;
2. нагревание вдыхаемого воздуха, потребляемой воды, пищи;
3. совершение внешней работы, связанной со всеми перемещениями человека и его трудовой деятельностью (при нормальной трудовой деятельности энергетические затраты человека покрываются за счет углеводов на 56 - 60 %, жиров на 20- 25 %, белков 15-20 %).
В процессе пищеварения углеводы разлагаются на глюкозу, которая растворяется в крови и реагирует с кислородом в несколько стадий.

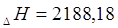 кДж
кДж
В связи с тем, что топливо и пища обычно представляют собой смеси, их теплотворная способность указывается в расчете не на 1 моль, а на 1 кг. Средняя калорийность углеводов  кДж/ кг, а жиров
кДж/ кг, а жиров 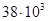 кДж/кг.
кДж/кг.
Суточная потребность человека в энергии составляет в среднем при умеренной и напряженной работе (лаборанты, врачи, учащиеся, студенты) 12500 -15100 кДж.
Направление самопроизвольно протекающих процессов. Движущие силы химического процесса. Понятие об энтропии.
Первое начало термодинамики утверждает, что все виды энергии взаимно превращаются в строго эквивалентных количествах. Но не даёт ответа на вопросы, почему процесс протекает именно в этом направлении, а не в обратном; настолько полно осуществляется превращение энергии из одного вида в другой.
Решение этих вопросов невозможно на основе первого начала, поэтому
используют иные термодинамические критерии.
В 1867 году Бертло сформулировал критерий возможности осуществления химических реакций:
1. Самопроизвольно могут протекать такие химические реакции,
которые сопровождаются выделением тепла.
Например:
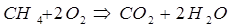 | 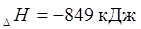 | |||||
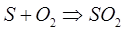 | 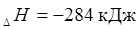 | |||||
Но существуют самопроизвольные процессы, которые сопровождаются поглощением тепла. Это эндотермические реакции типа:
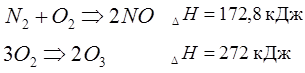 |
Очевидно, не одно только стремление системы свести к минимуму свой запас внутренней энергии, выделить избыток этой энергии в окружающую среду является движущей силой для самопроизвольного протекания химических и физико-химических процессов.
2. Стремление системы к максимальному беспорядку.
Например: имеются два газообразных баллона, соединенных трубкой с краном и заполненные не реагирующими друг с другом газами азотом и оксидом углерода СО, имеющими одинаковые t, Р и молекулярные массы . После открытия крана начинается активный процесс смешения газов. Наблюдается стремление системы к беспорядку.
Самопроизвольный процесс смешения газов в этом примере будет протекать без изменения энтальпии. Но обратный процесс разделения газов самопроизвольно протекать не будет: его можно осуществить, только затрачивая работу из вне. В самопроизвольных процессах система переходит от менее вероятного состояния к более вероятному.
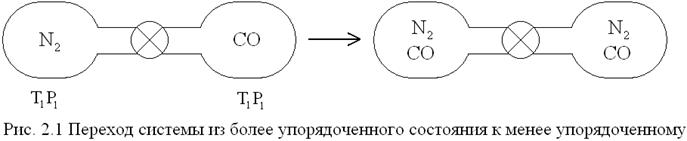 |
Мерой беспорядка системы служит энтропия S ( Дж/моль·К);
Второй закон термодинамики.
Самопроизвольный процесс, происходящий без изменения энергетического запаса системы совершается только в направлении, при котором энтропия возрастает (S>О);
Австрийским физиком Больцманом было установлено
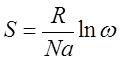
Энтропия - это логарифмическое выражение вероятности существования системы.
R - универсальная газовая постоянная = 8,314 Дж/моль К;
N - постоянная Авогадро ( 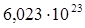 );
);
Следовательно, чем большим числом макрочастиц представлена рассматриваемая макросистема, тем больше вариантов распределение этих частиц, при которых может быть достигнуто макросостояние, тем выше значение энтропии.
1. С повышением температуры энтропия возрастает, так как усиливается неупорядоченность, хаос в системе, т.е.:
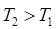 , то
, то 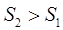
2. Энтропия скачкообразно увеличивается при переходе вещества (кристаллического) в жидкое, т.е. в процессе плавления:
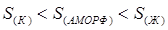
Для веществ в кристаллическом состоянии характерна упорядоченность частиц и наличие ближнего и дальнего порядка. Частицы расположены в строгой последовательности.
Зависимость энтропии от температуры t можно выразить графиком:
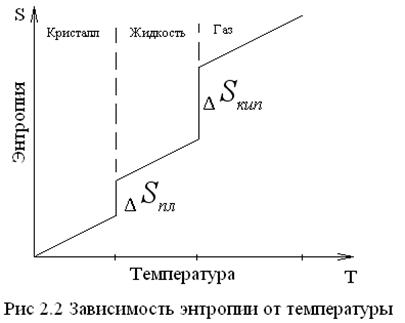
Здесь необходима различать постепенное изменение энтропии ( 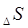 ) за счет изменения параметров состояния (Т) и скачкообразное – в результате фазовых переходов и химических реакций.
) за счет изменения параметров состояния (Т) и скачкообразное – в результате фазовых переходов и химических реакций.
3. Процессы — нагревания, кипения, диссоциации, вызывающие увеличение
беспорядка сопровождаются увеличением энтропии.
4. Кристаллизация, полимеризация связана с уменьшением объема, сопровождаются уменьшением энтропии.
5. Чем тверже вещество, тем меньше его энтропия, чем мягче, тем энтропия больше.
По группам сверху вниз наблюдается увеличение энтропии. В отличие от всех других термодинамических функций энтропия имеет абсолютное значение.
