Требования, предъявляемые к сточной воде
Для сохранения водных ресурсов необходимо переходить на замкнутые циклы водоснабжения, где очищенные сточные воды не сбрасываются, а многократно используются в технологических процессах. Большое количество воды расходуется на охлаждение, поэтому переход к воздушному охлаждению позволит сократить расход воды, используемой в промышленности, на 70-90 %.
При определении условий спуска сточных вод в водоем в первую очередь рассматриваются следующие возможности:
1. Совершенствование технологии производства, направленное на сокращение водопотребления и сброса сточных вод в водоем (вплоть до его устранения); использование сточных вод в системах оборотного водоснабжения, а также уменьшение степени загрязнения сточных вод.
2. Использование очищенных и обезвреженных городских сточных вод в технологическом водоснабжении предприятий.
3. Использования сточных вод данного предприятия для технического водоснабжения других предприятий.
4. Совместная очистка и обезвреживание сточных вод данного предприятия со сточными водами других предприятий и с городскими сточными водами.
5. Самостоятельная очистка и отведение сточных вод.
Сброс сточных вод не допускается:
1. При размещении предприятия на маломощном водоеме, когда возможность разбавления в нем сточных вод и его самоочищение ограничено.
2. При наличии в сточных водах высокотоксичных веществ, ПДК которых в водоеме чрезвычайно низки.
3. Когда на водоеме расположены другие объекты, создающие в водоеме высокий уровень загрязнения.
Таблица 1
Способы очистки сточных вод в зависимости от их состава
| Примеси | Способы очистки | |||
| механические | химические | физико-химические | биологические | |
| Грубо-дисперсные | Отстаивание | - | - | - |
| Фильтрование | ||||
| Центрифугирование | ||||
| Эмульгированнные | - | - | Коагуляция | - |
| Флотация | ||||
| Адсорбция | ||||
| Органические вещества | - | Нейтрализация | Комплексообразование | Разложение микроорганизмами |
| Минеральные вещества | - | Нейтрализация | Кристаллизация | - |
| Перевод в нерастворимое состояние | Ионный обмен | |||
| Электролиз | ||||
| Дистилляция | ||||
| Газы | - | Нейтрализация | Адсорбция | - |
| Термическое воздействие | ||||
| Микроорганизмы | - | Хлорирование | Облучение УФ-лучами | - |
| Озонирование |
Экспериментальная часть
Материалы и оборудование.Конические колбы вместимостью 250 мл; воронки химические (большая и маленькая); цилиндр на 100 мл; химические стаканы вместимостью 50, 100, 250 мл, набор пробирок, бумажные фильтры.
Ионообменная колонка с катионитом или любым сорбентом, песчаный фильтр, штатив с кольцами.
Реактивы. Раствор соляной кислоты (1:1), раствор азотной кислоты, 5%-й раствор хлорида бария, 10%-й раствор нитрата серебра, 10%-й раствор роданида аммония, раствор карбоната натрия, раствор известкового молока, активированный уголь, проба исследуемой воды.
Данная лабораторная работа посвящена изучению способов очистки сточных вод. До и после каждого вида очистки в воде определяют содержание хлорид-ионов и ионов железа.
Полуколичественное определение ионов, содержащихся в воде
Определение содержания хлоридов
Выполнение опыта. В пробирку наливают 3–5 мл воды (примерно 1/3 объема пробирки), 2–3 капли азотной кислоты и затем добавляют 2–3 капли 10%-го раствора нитрата серебра
Ag+ + С1‾ = AgС1↓ (белого цвет).
Появление осадка или мути указывает на присутствие в воде хлоридов. По табл. 2 определите полуколичественное определение хлоридов.
Таблица 2
Данные для определения содержания хлоридов в воде
| Характеристика осадка или мути | Содержание хлоридов, мг/л |
| Опалесценция или слабая муть | 1 – 10 |
| Сильная муть | 10 – 50 |
| Образуются хлопья, осаждаются не сразу | 50 – 100 |
| Белый объемистый осадок | Более 300 |
Для того чтобы убедиться, что осадок образовался за счет хлорид-ионов, в пробирку можно добавить несколько капель азотной кислоты. Нерастворившийся осадок или муть свидетельствует о содержании в воде хлоридов.
Результаты определения занести в табл. 5.
Определение содержания катионов железа
Выполнение опыта. Для определения содержания в воде солей железа наливают 1/3 пробирки испытуемой воды, добавляют несколько капель азотной кислоты (для создания кислой среды и для окисления двухвалентного железа в трехвалентное) и прибавляют 5 капель 10% раствора роданида аммония NH4CNS. При наличии ионов Fe3+ появляется красное окрашивание:
Fe3+ + 3NH4CNS → Fe(CNS)3 + 3NH4+.
Примерное содержание трехвалентного железа определяется по цвету раствора (табл. 3).
Таблица 3
Шкала оценки содержания Fe3+
| Цвет раствора | Желтовато-красный | Красный | Ярко-красный |
| Содержание Fe3+, мг/л | 0,4 – 1,0 | 1,1 – 3,0 | 3,1 – 10,0 |
Результаты занести в табл. 5.
Определение мутности
Мутность природных вод вызвана присутствием тонкодисперсных примесей, обусловленных нерастворимыми или коллоидными неорганическими и органическими веществами различного происхождения.
Мутность определяют фотометрически (турбидиметрически – по ослаблению проходящего света или нефелометрически – по светорассеянию в отраженном свете) или визуально. В соответствии с гигиеническими требованиями к качеству питьевой воды мутность не должна превышать 1,5 мг/дм3 по каолину.
В лаборатории мутность воды определяют визуально – по степени мутности столба жидкости высотой 10–12 см в мутномерной пробирке (ГОСТ 24902–81).
Выполнение анализа. Оборудование. Пробирка стеклянная высотой 10–12 см; лист темной бумаги (в качестве фона).
Заполните пробирку исследуемой водой до 10–12 см. Определите мутность воды, рассматривая пробирку сверху на темном фоне при достаточном боковом освещении (дневном, искусственном). Выберите подходящее определение для воды, из приведенных в таблице 4.
Таблица 4
Мутность воды
| Оценка интенсивности мутности | Оценка интенсивности мутности |
| Мутность не заметна (отсутствует) | Слабо мутная |
| Слабо опалесцирующая | Мутная |
| Опалесцирующая | Очень мутная |
Очистка воды
Механическая очистка
Фильтрование – это общее название для различных способов очистки жидкости от твердых частиц. Фильтрование заключается в пропускании смеси через материал (фильтр), задерживающий твердые частицы. Жидкость, собираемая после фильтрации, называется фильтратом. В данной работе для механической очистки (рис. 2) используются:
а) бумажные фильтры для извлечения из воды крупных примесей и мелких примесей. Пробу исследуемой воды отфильтровывают на бумажном фильтре и делают вывод о присутствии в природной воде частиц размерами менее 0,01 мм;
б) фильтрование через песок. Песочный фильтр захватывает твердые загрязнения, которые слишком велики, для того чтобы пройти между песчинками. В песчаном фильтре – нижний слой гравия предотвращает вымывание песка через дырки, верхний слой гравия нужен для того, чтобы песок не взмучивался при вливании воды.
Выполнение опыта. Профильтруйте исследуемый раствор, используя бумажный и песчаный фильтры (примерно по 100–150 мл).
а) 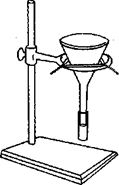 б)
б) 
Рис. 2. Фильтрование: а) на воронке с бумажным фильтром; б) песчаный фильтр
После механической очистки определите:
а) содержание в фильтрате ионов хлора и железа;
б) мутность раствора после фильтрования.
Сравните полученные результаты, с результатами, полученными до механической очистки раствора, и сделайте вывод.
Результаты определения занесите в табл. 5.
Химическая очистка
Для исследования используют пробы воды, прошедшей предварительную механическую очистку. Для осаждения ионов металлов из растворов применяются реагенты–осадители, при взаимодействии которых с извлекаемым ионом должен получиться крупнокристаллический труднорастворимый осадок.
Выполнение опыта. В две одинаковые пробирки налейте по 10 мл очищаемой воды. В первую пробирку добавляют 2 мл раствора карбоната натрия (Na2CO3), во вторую - 2 мл раствора гидроксида кальция (Ca(OH)2 или известкового молока). По появлению мути или осадка судят об эффективности химической очистки в каждом случае.
2Fe3+ + 3 CO32- + 3 H2O → 2Fe(OH)3↓ + 3CO2↑
2Fe3+ + 3 Ca(OH)2 → 2Fe(OH)3↓ + 3Ca2+ .
При добавлении раствора соды к раствору соли железа протекает взаимодействие двух солей, взаимно усиливающих гидролиз друг друга.
Содержимое каждой пробирки отфильтруйте при помощи бумажного фильтра. В фильтратах определите остаточное содержание исследуемых ионов Cl- и Fe3+, сравните их с концентрацией ионов в исходном растворе, сделайте вывод. Результаты занести в табл. 5.
