Тема 13.2. ВОЗБУДИТЕЛИ БРЮШНОГО ТИФА, ПАРАТИФОВ И ИЕРСИНИОЗОВ. ДИСБАКТЕРИОЗ
Современная классификация бактерий рода Salmonella. Род
Salmonella включает 2 вида: S.enterica (2307 сероваров) и S.bon-gori (17 сероваров). Вид S.enterica включает 5 подвидов: enterica (I), salamae (И), arizonae (Ilia), diarisonae (Illb), houtenae (IV), indica (V), которые вьщелены на основании молекулярно-гене-тических признаков (гибридизационного анализа ДНК) и фе-нотипически различаются по биохимическим свойствам. Внутри подвидов сальмонеллы подразделяются на серовары по О-и Н-антигенам согласно классификации Кауфмана—Уайта. Необходимо помнить, что представители разных подвидов могут иметь общие или идентичные антигены. Абсолютное большинство сероваров (1367) относятся к подвиду enterica. Согласно ранее существовавшей классификации, сальмонеллы — представители различных сероваров — рассматривались как самостоятельные виды и имели собственные видовые названия. В настоящее время старые видовые названия используют для обозначения биоваров (сероваров), например S.enterica подвида enterica серовара typhimurium соответствует S.typhimurium, cepo-вара typhi — S.typhi, серовара paratyphi A — S.paratyphi А и т.д. Природным резервуаром бактерий S.enterica подвида enterica являются теплокровные животные, для остальных — холоднокровные животные и окружающая среда. Возбудители заболеваний человека относятся к подвиду enterica.
С эпидемиологической точки зрения сальмонеллы, вызывающие заболевания человека, относят к трем основным группам. Первая группа включает 3 биовара: typhi, paratyphi А и С, которые являются возбудителями строгих антропонозов (инфицируют только человека и передаются от человека к человеку прямо или опосредованно — через пищу, воду). Вторая группа включает серовары, которые адаптировались к определенному виду животных. Некоторые из этих сероваров патогенны для человека (dublin, gallinarum, schottmulleri и др.). К третьей группе относятся большинство сероваров, не имеющих специфических хозяев и способных инфицировать как человека, так и животных. По клинической классификации сальмонеллы подразделяют на возбудителей брюшного тифа (биовар typhi) и паратифов (биовары paratyphi А, С и schottmulleri) и возбудителей сальмонеллезов, включающих все остальные биовары сальмонелл, патогенных для человека. Большинство возбудителей сальмонеллезов относится к третьей группе по эпидемиологической классификации.
План
Программа
Биологические свойства возбудителей брюшного тифа, паратифов и иерсиниозов. Их патогенность, экология, особенности инфекции и эпидемиология вызываемых заболеваний. Дисбактериоз.
Лабораторная диагностика.
Диагностические, профилактические и лечебные препараты.
Демонстрация
Мазки из чистых культур возбудителей кишечных инфекций: Salmonella enterica биоваров typhi, paratyphi A, typhimurium, Proteus vulgaris. Окраска по методу Грама.
Диагностические и лечебно-профилактические препараты.
Задание студентам
Микроскопировать и зарисовать мазки из чистых культур возбудителей кишечных инфекций.
Лабораторная диагностика кишечных инфекций.
2.1. Диагностика брюшного тифа и паратифов.
А. Бактериологическая диагностика:
выбрать материал для исследования;
учесть результаты первичного посева исследуемого материала на среду Раппопорт;
учесть результаты пересева бактерий со среды Раппопорт на среду Эндо. Описать и зарисовать колонии, выросшие на среде Эндо, и обосновать выбор подозрительных колоний для
дальнейшего исследования;
учесть результаты пересева подозрительных колоний со среды Эндо на среду Ресселя;
учесть результаты идентификации выделенной чистой культуры по биохимическим свойствам;
сделать вывод и наметить план дальнейшего исследования.
Б. Серодиагностика. Проанализировать результаты реакции Видаля.
2.2. Бактериологическая диагностика сальмонеллезов:
выбрать материал для исследования;
учесть результаты первичного посева исследуемого материала на висмут-сульфит агар. Описать и зарисовать колонии и обосновать выбор подозрительных колоний для дальнейшего исследования;
учесть результаты пересева подозрительных колоний на среду Ресселя;
учесть результаты идентификации выделеннойчистой культуры по биохимическим свойствам;
сделать вывод и наметить план дальнейшего исследования.
3. Ознакомиться с диагностическими и лечебно-профилактическими препаратами.
Методические указания
• Микробиологическая диагностика брюшного тифа и пара-тифов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: исходя из особенностей патогенеза брюшного тифа, на 1-й неделе заболевания, в период бактериемии, возбудителей выделяют из крови (получение гемокультуры), со 2-й недели заболевания — из испражнений (получение копрокультуры), мочи или желчи.
МЕТОДЫ ДИАГНОСТИКИ:
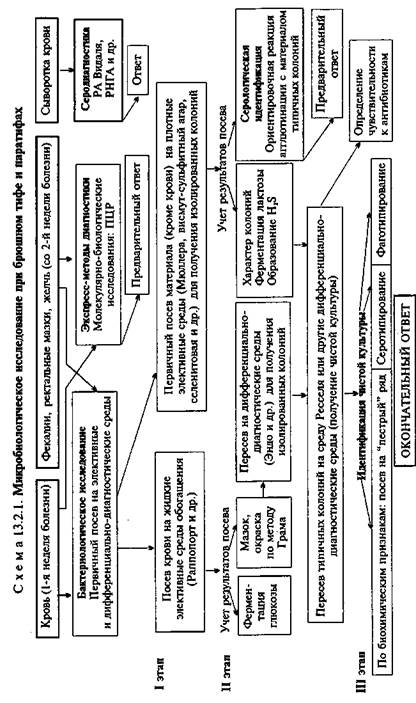
Бактериологическое исследование (схема 13.2.1).
Получение гемокультуры. В 1-й день из локтевой вены больного берут 5—10 мл крови и засевают в колбу с 50—100 мл селективной среды Раппопорт, содержащей желчный бульон (для подавления роста других бактерий), глюкозу, индикатор Андреде и поплавок для обнаружения газа. Указанные соотношения крови и среды необходимы для подавления бактерицидного действия белков крови. Посевы инкубируют при 37 °С в течение 18—20 ч. На 2-й день при росте сальмонелл наблюдается помутнение и изменение цвета среды. При росте паратифозных бактерий (биоварыparatyphi А, Си schottmuelleri) наряду с указанными изменениями появляются пузырьки газа в поплавке. Для ускорения ответа из среды Раппопорт делают мазки и препараты "висячая" капля. При наличии чистой культуры грамотрицательных подвижных палочек и изменении цвета среды (или наличии газа) дают первый предварительный ответ. Затем культуру из среды Раппопорт пересевают в пробирку со средой Ресселя, полагая при этом, что из крови выделена чистая культура и можно сразу приступить к ее идентификации. Одновременно со среды Раппопорт делают посевы на среду Эндо для получения изолированных колоний с целью проверки чистоты выделенной культуры.
На 3-й день отмечают ферментацию глюкозы на среде Ресселя и ставят ориентировочную реакцию агглютинации на стекле. На основании полученных данных дают второй предварительный ответ. Для дальнейшего исследования отбирают несколько бесцветных колоний со среды Эндо и пересевают их в среду Ресселя или скошенный питательный агар (для контроля полученных результатов). Чистую культуру пересевают на среды "пестрого" ряда и серотипируют в реакции агглютинации на стекле со смесью групповых сывороток, а затем с
| Биовар Ферментация Образование S. enterica 1 1 i \ i лак- глю- маль- саха- ман- H2S NH3 индо- тозы козы тозы розы нита ла ТурЫ -КК-К + --ParatyphiA - КГ КГ - КГ - - -Schottmuelleri - КГ КГ - КГ + + - |
| Род Лизин- Ферментация углеводов р- декар- 1 1 1 1 1 Галак- бокси- дуль- сор- кси- рам- сали- 4 % този- лаза цита бита лозы нозы цина лактозы даза Salmonella ± К(-) К К К - - -Citrobacter - K(-) К К К К(±) К(±) К Hafnia + - - К К К(±) - К |
товая или висмут-сульфит агар). Для посева петлю фекалий вносят в пробирку с изотоническим раствором хлорида натрия и готовят суспензию. После оседания крупных комочков суспензию петлей наносят на поверхность агаровой среды — на одну половину чашки. Материал тщательно растирают шпателем по одной, а затем по другой половине чашки для получения изолированных колоний. Посевы инкубируют при 37 "С в течение 18—20 ч. На 2-й день изучают характер колоний, выросших на чашках (рис. 13.2.1; на вклейке), пересевают 2—3 бесцветные колонии (со среды Эндо или Левина) или колонии черного цвета (висмут-сульфит агар) на среду Ресселя и в пробирки со скошенным питательным агаром. При отсутствии подозрительных колоний на чашках делают высевы из среды Мюллера или селенитовой среды на чашки со средой Эндо для получения изолированных колоний. Для ускорения ответа ставят ориентировочную реакцию агглютинации на стекле с материалом, взятым из бесцветной колонии. Далее поступают так же, как и при идентификации гемокультуры.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. В лабораторной практике широко применяют развернутую реакцию агглютинации Видаля, основанную на обнаружении в сыворотке крови людей антител — агглютининов, которые появляются в конце 1-й — начале 2-й недели заболевания. Реакцию ставят одновременно с четырьмя антигенами: О- и Н-брюшнотифозными, А- и В-паратифозными диагностикумами. Брюшнотифозные монодиагностикумы применяют для установления стадии болезни, так как содержание О- и Н-антител в разные ее периоды неодинаково. О-антитела появляются на 1-й неделе, накапливаются в разгар заболевания и исчезают к моменту выздоровления. Н-антитела появляются в разгар заболевания, накапливаются к концу заболевания и сохраняются у переболевших в течение длительного времени. У людей, вакцинированных против брюшного тифа и парати-фов, также наблюдается положительная реакция Видаля, причем в довольно высоком титре, поэтому "инфекционный Ви-даль" удается отличить от "прививочного" только по нарастанию титра агглютининов у больных в процессе заболевания. Реакцию Видаля ставят в четырех рядах пробирок по 7 пробирок в каждом ряду, из которых 5 опытных и 2 контрольные. Для контроля каждого диагностикума в пробирки вносят по 1 мл изотонического раствора хлорида натрия, в который добавляют 2 капли диагностикума. В контрольной пробирке с 1 мл сыворотки (без диагностикума) не должно быть хлопьев. При спонтанной агглютинации реакция не учитывается. Диагностический титр реакции Видаля равен 1:200. Для серологического исследования реконвалесцентов и выявления бактерионосителей широко используют реакцию непрямой К/'-гемаг-глютинации, с помощью которой в сыворотке крови людей определяют присутствие антител к К/-антигену. В качестве антигена используют эритроцитарный И-диагностикум, представляющий собой взвесь эритроцитов человека 1(0) группы, обработанных формалином и сенсибилизированных И-антиге-ном S.enterica биовара typhi. Готовят разведения испытуемой сыворотки от 1:10 до 1:1280. При положительной реакции эритроциты покрывают дно пробирки в виде диска с зазубренными краями, а надосадочная жидкость остается прозрачной. При отрицательной реакции, так же как и в контроле, эритроциты осаждаются на дно пробирки и имеют вид диска с ровными краями ("пуговки"). Диагностическое значение имеет титр пассивной К/-гемагглютинации, начиная с 1:40 и выше. Всех лиц, сыворотка крови у которых дает положительный результат в РИГА с эритроцитарным К/-диагностикумом, рассматривают как подозрительных на носительство S.enterica биовара typhi и подвергают многократному бактериологическому обследованию.
• Микробиологическая диагностика сальмонеллезов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь.
МЕТОДЫ ДИАГНОСТИКИ: микробиологическая диагностика сальмонеллезов принципиально не отличается от диагностики брюшного тифа и паратифов. Серодиагностика не применяется по причине большого числа сероваров возбудителей.
• Микробиологическая диагностика кишечного иерсиниоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь, моча, спинномозговая жидкость.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование. Посев материала на дифференциально-диагностические (среда Эндо, Мак-Конки, СБТС-агар с желчью и бромтимоловым синим) и селективные (CIN-агар с антибиотиками цефсулодином и новобиоцином) плотные среды или жидкие среды обогащения (буферно-казе-иново-дрожжевой бульон, 1 %, пептонная вода с рН 7,6—7,8). Посевы инкубируют при 25 "С в течение 24—48 ч. Идентификация чистой культуры осуществляется на основании морфологии, подвижности, тинкториальных свойств (грамотрицательные палочки с закругленными концами и характерным биполярным окрашиванием, неспорообразующие, перитрихи), культуральных, биохимических признаков.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Диагностическое значение имеет обнаружение антител к поверхностным антигенам возбудителей наиболее распространенных серотипов (ОЗ, О4, О5, Об, О8, О9) в РА. Положительной считается РА в титре не менее 1:160. Разработаны также ИФА-тесты.
• Микробиологическая диагностика кишечного дисбактериоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии. МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование. Имеет ориентировочное значение. При резко выраженном дисбактериозе в мазках преобладают микроорганизмы определенных видов (например, дрожжеподобные грибы, стафилококки и др.) на фоне существенного уменьшения грамотрицательной микрофлоры.
Бактериологическое исследование. Проводится количественное исследование состава микрофлоры кишечника. Для этого из исследуемого материала готовят разведения 10~2, 10~4, 10~^ и т.д. Первичные посевы по 0,1 мл каждого разведения производят параллельно на несколько питательных сред (Эндо, кровяной агар, ЖСА, агар Сабуро и др.) и инкубируют при 37 °С. Подсчитывают число выросших колоний и определяют число КОЕ в 1 г материала. Проводят отсев 2—3 колоний каждого вида для выделения и идентификации чистых культур микроорганизмов.
Для обнаружения анаэробных Bifidobacterium spp, делают мерные посевы материала в разведениях 10~7 и выше в пробирки с 13—15 мл модифицированной среды Блаурокка, в состав которой входит печеночный бульон, пептон — 1 %, лактоза — 1 %, хлорид натрия — 0,5 %, цистин — 0,01 %, агар-агар — 0,75%, твин-80 — 0,1 %. При росте Bifidobacterium spp. через 24—48 ч происходит помутнение всей среды с образованием тяжей или отдельных колоний. Готовят мазки и окрашивают по методу Грама. Выделение чистых культур Bifidobacterium spp. является весьма трудоемким и практически необязательным. При необходимости идентификацию представителей рода осуществляют по биохимическим свойствам.
Для оценки результатов бактериологического исследования
| Микроорганизмы Норма Патогенные микробы сем. Enterobacteriaceae 0 Общее количество E.coli, млн/г 300—400 E.coli со слабовыраженными ферментативными свойствами, % До 10 E.coli с гемолитическими свойствами, % Нет Энтеробактерии (лактозоотрицательные и лактозополо-жительные): Hafhia, Aerobacter, Citrobacter, Klebsiella, Serratia, % До 5 Кокковые формы, % До 25 Гемолитический стафилококк по отношению ко всем кокковым формам, % Нет Bifidobacterium spp. (рост при посеве разведения) 10 и выше Бактерии рода Proteus Нет Грибы рода Candida Нет |
Получают так же, как и другие диагностические сыворотки. Применяют для серотипирования сальмонелл в реакции агглютинации.
Сальмонеллезные О- и Н-монодиагностикумы. Представляют собой взвеси сальмонелл, убитых нагреванием (О-диагностику-мы) или обработкой формалином (Н-диагностикумы). Применяют для серодиагностики брюшного тифа в реакции Видаля.
Типовые сальмонеллезные бактериофаги. Применяют для фа-готипирования сальмонелл.
Брюшнотифозная моновакцинд и брюшнотифозная спиртовая вакцина, обогащенная Vi-антигеном. Применяют для специфической активной профилактики брюшного тифа.
Поливалентный брюшнотифозный бактериофаг. Выпускается в виде таблеток с кислотоустойчивым покрытием. Применяют для экстренной профилактики брюшного тифа.
Коли-бактерин. Содержит лиофильно высушенные живые клетки E.coli штамма М17, обладающего выраженными антагонистическими свойствами в отношении ряда патогенных кишечных бактерий. Применяют для нормализации кишечной микрофлоры при дисбактериозе и лечении дизентерии, главным образом у детей.
Бифидумбактерин. Содержит лиофильно высушенную взвесь живых клеток B.bifidum. Применяют для лечения хронических кишечных инфекций невыясненной этиологии у детей и дизентерии.
Бификол. Содержит смесь высушенных живых бактерий E.coli штамма М17 и B.bifidum. Показания к применению те же.
Лактобактерин. Содержит продукты жизнедеятельности лак-тобактерий. Выпускается в таблетированном виде. Применяют для лечения дисбактериозов у детей.
Антибиотики: сульфаниламиды, полусинтетические пени-циллины, цефалоспорины 2—4-го поколения, хлорамфеникол, тетрациклины, фторхинолоны, полимиксин.
