Окислительное декарбоксилирование пирувата
Превращение пирувата в ацетил-КоА
Стадия I. Реакция декарбоксилирования пирувата.
Значение декарбоксилирования пирувата в отношении извлечения энергии из молекулы исключительно велико. Три углеродных атома пирувата имеют разную степень окисления. Углерод метильной группы (-СНз) не окислен и, следовательно, в дальнейшем при его окислении можно получить полезную энергию. Углерод кето-группы (>С=О) окислен частично. При его дальнейшем окислении можно также извлечь некоторое количество дополнительной энергии. А углерод карбоксильной группы окислен почти полностью. Поэтому карбоксильная группа - это до некоторой степени балластная часть молекулы с позиции извлечения энергии. Её необходимо удалить. Удаление карбоксильной группы (т.е. реакцию декарбоксилирования) катализирует фермент пируватдегидрогеназа, в активном центре которого локализован тиаминдифосфат - кофермент декарбоксилирования.
Пируват + Е1-ТДФ → Гидроксиэтил-ТДФ + CO2.
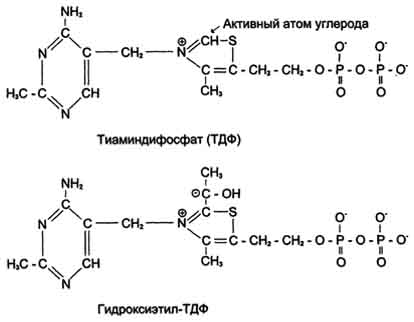
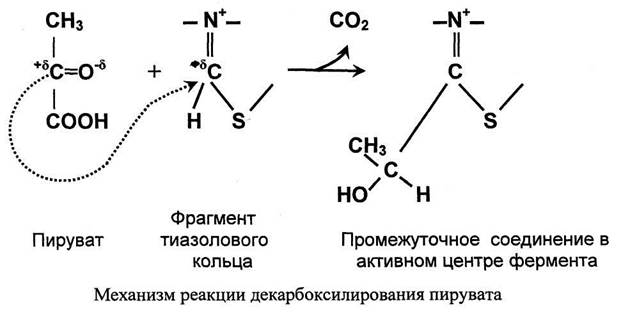
Тиаминдифосфат (ТДФ) и гидроксиэтил-ТДФ. Рабочей частью ТДФ служит тиазоповое кольцо, к которому присоединяется продукт декарбоксилирования пирувата - гидроксиэтил. В активном центре фермента происходит прямое взаимодействие двух атомов углерода с образованием между ними ковалентной связи. Это взаимодействие обусловлено частичными разноименными зарядами, которыми обладают углерод кето-группы пирувата с одной стороны и атом углерода тиазолового кольца тиаминпирофосфата с другой.
2. На этой стадии E1 (пируватдегидрогеназа) переносит атом водорода и двухуг-
леролеродный ацетильный фрагмент (СН3-СО-) на молекулу липоевой кислоты,
локализованную в активном центре фермента Е2 (дигидролипоамидацетилтранс-
феразы). При этом в активном центре фермента образуется ацетилтиоэфир липое
вой кислоты.
3. В этой реакции KoA-SH атакует тиоэфирную связь в активном центре фермента
Е2, разрывает её и присоединяет к себе двухуглеролеродный ацетильный фрагмент (СНз-СО-). Происходит образование ацетил~КоА, который покидает активный центр фермента Е2 (дигидролипоамидацетилтрансферазы). При этом оба атома серы липоевой кислоты полностью восстановлены.
4. В этой реакции фермент Е3 (дигидролипоамиддегидрогеназа) катализирует
перенос двух атомов водорода с восстановленной липоевой кислоты, находящейся в активном центре фермента Е2 на кофермент ФАД, локализованный в своём актив
ном центре. При этом в активном центре фермента Е3 образуется ФАДН2.
5. В активный центр дегидрогеназы (Е3) пируватдегидрогеназного комплекса входит НАД+ и присоединяет к себе 2 электрона и протон от кофермента ФАДН2 и в
форме НАДН переносит их в процесс окислительного фосфорилирования.
Связь окислительного декарбоксилирования пирувата с процессом окислительного фосфорилирования
При превращении пирувата в ацетил-КоА происходит образование НАДН, транспортирующего электроны в дыхательную цепь. Из пары высокоэнергетических электронов в процессе окислительного фосфорилирования может синтезироваться до 3 молекул АТФ. Усиление распада АТФ в клетке ведет к повышению концентрации АДФ и ускорению окисления НАДН в дыхательной цепи. Повышение концентрации НАД+, в свою очередь, стимулирует окислительное декарбоксили-рование пирувата. Напротив, повышение концентрации АТФ и НАДН снижает скорость этого процесса.
Таким образом, изменения отношений АДФ/АТФ и НАДН/НАД+ - важнейшие внутриклеточные регуляторные сигналы, отражающие энергетические потребности клетки и регулирующие скорость окислительного декарбоксилирования пирувата. Каталитическая активность пируватдегидрогеназного комплекса снижается, когда в клетках имеется достаточно "топлива" в виде жирных кислот и аце-тил~КоА.
Структурное объединение 3 видов ферментов создаёт возможности для координации отдельных этапов сложной ферментативной реакции. Все промежуточные продукты реакции окислительного декарбоксилирования пирувата прочно связаны с комплексом, что увеличивает суммарную скорость процесса и сводит к минимуму побочные реакции.
Пируватдегидрогеназный комплекс, как и все белки, участвующие в реакциях ЦТК, кодируется ядерной ДНК. Транспорт субъединиц ПДК в митохондрии происходит сложным путём за счёт энергии АТФ или трансмембранного электрохимического потенциала при участии белков теплового шока (или шапперонов), предотвращающих их преждевременный фолдинг до поступления в митохондриальный матрикс или внутреннюю мембрану митохондрий.
.
