Элементный состав белков
В белках содержится до 55% – С; 20-25% – О; 16% – N, а также S, P, Mgи др. Доля азота в отличие от других элементов примерно одинакова и составляет 16% и содержание белка в материале часто определяют по количеству азота (сжигание по Къельдалю). Исключение составляет белки-протамины, которые содержат ~30% N.
Mr – относительная молекулярная масса белков. Она очень велика: от ≈6000Да до нескольких миллионов Да.
Например, Mr инсулина = 5733 Да, а вируса табачной мозаики – 40 млн.Да
Мономеры или структурные звенья белков.
Их можно определить путем кислотного гидролиза белков. Мономерами белков являются α-АК L-ряда. Соединение АК в полипептидную цепь (ППЦ) происходит посредством ковалентных пептидных связей –CO–NH–.
Сложная структурная организация.
Некоторые природные, а также искусственно полученные полипептиды могут иметь большую Mr, но отнести их к белкам нельзя. Отличает их от белков уникальный признак, присущий только белкам – денатурация. При действии определенных веществ, так называемых детергентов, происходит потеря белком физико-химических свойств, а главное – биологической активности, при этом пептидные связи не разрываются. Таким образом, белки обладают сложной пространственной организацией.
Таковы характерные признаки белков.
Форма белковых молекул.
В природе белки встречаются как в виде нитей – фибрилл, так и в виде шариков – глобул. Иногда глобулярные и фибриллярные формы встречаются в виде комплексов (в мышечной ткани комплекс актина с миозином; в плазме крови содержится фибрилл белка – фибриноген, а также глобулы белка – альбумины и глобулины).
Функции белков.
1. Каталитическая – более 99% ферментов или биологических катализаторов являются белками; например каталаза, аспартат-аминотрансфераза. К 90-м годам 20 в. идентифицировано более 2000 ферментов белковой природы.
2. Питательная (или резервная) – казеин – белок молока, овальбумины – белки яйца.
3. Транспортная – дыхательная функция крови, в частности, перенос О2 осуществляется гемоглобином (Нв) - белком эритроцитов.
4. Защитная – специфические защитные белки-антитела нейтрализуют действие чужеродных белков-антигенов.
5. Сократительная – специфические белки мышечной ткани актин и миозин обеспечивают мышечные сокращения и расслабления, т.е. движение.
6. Структурная – такую функцию выполняют белки – коллаген соединительной ткани, кератин – в волосах, ногтях, коже.
7. Гормональная – регуляция обмена веществ осуществляется за счет гормонов – белков или полипептидов гипофиза, поджелудочной железы.
Физико-химические свойства аминокислот
α-АК являются строительными блоками, из которых образуются белковые полипептидные цепи (ППЦ) и, собственно, сами белки. Аминокислоты – это производные карбоновых кислот, в которых один из водородов углеродной цепи замещен на R.
Путем гидролиза из животных белков выделяют 19-25 α-АК, но обычно их получают 20. Общая формула аминокислот:
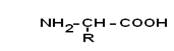
Аминокислоты – это бесцветные кристаллические вещества, плавящиеся при высоких температурах (>250°С). Легко растворимы в воде и нерастворимы в органических растворителях. Имея в своем составе NH2–группу основного характера и COOH– с кислыми свойствами, АК обладают амфотерностью. В водных растворах α-АК в основном существуют в виде биполярных ионов или цвиттер-ионов с диссоциированной COO––группой и протонированной NH3+–группой.
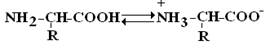
Цвиттер-ион
В зависимости от рН–среды АК могут быть в виде анионов, катионов, нейтральных биполярных ионов или в виде смеси их форм.
В сильнокислой среде АК присутствуют в виде катионов (q +)
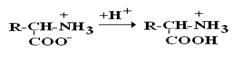
в сильнощелочной среде – в виде анионов (–q)
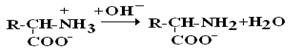
Величина рН, при которой в водном растворе преобладает цвиттер-ион, т.е. равновесная концентрация «+» и «–» q аминокислот, а также белков, называется изоэлектрической точкой(pI). При достижении такой рН белок становится неподвижным в электрическом поле и выпадает в осадок, что используется в электрофоретических методах анализа белков и аминокислот.
Стереохимия аминокислот.
Важным свойством АК является их оптическая активность в водных растворах. Это свойство АК обусловлено наличием в их структуре хирального атома С. Хиральным атомом или хиральным центром называется атом, у которого все связи замещены различными радикалами (R):
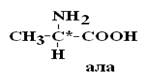 | 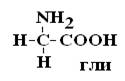 |
Оптически неактивной является только АК глицин, которая не имеет хирального центра.
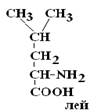
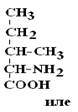
Существуют два вида изомеров – структурные и стереоизомеры.
Структурные изомеры – это вещества с одинаковой Mr, но различной последовательностью связывания атомов в молекуле.
 |  |
Стереоизомеры– это изомеры с одинаковой последовательностью соединения атомов, но с различным их расположением в пространстве.
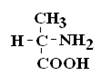 | 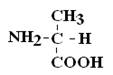 |
Если 2 стереоизомера относятся друг к другу как предмет и его зеркальное отражение, их называют энантиомерами.
Энантиомеры всегда проявляют одинаковые химические и физические свойства за исключением одного – направления вращения плоскости поляризованного луча. Энантиомер, вращающий плоскость поляризации по часовой стрелке, называется правовращающим («+»), а против часовой стрелки – левовращающим («–»). Природные аминокислоты являются как «+», так и «–».
Смесь равного количества молекул правого и левого энантиомеров называется рацемической смесью.
Рацематы не обладают оптической активностью. По пространственному расположению атомов и радикалов вокруг хирального центра различают аминокислоты Д– и L–ряда. Для определения принадлежности АК к Д– или L–ряду сравнивают конфигурацию ее хирального центра с энантиомером глицеральдегида (ГА).
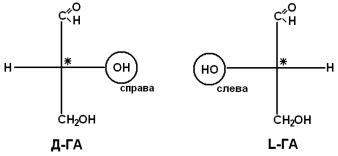
По аналогии, в аминокислотах если NH2–группа расположена справа от оси СООН-R, то это Д–АК, а если слева – L–АК.
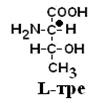 | 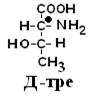 |
Все аминокислоты природных белков являются α–АК.
