Микроскопические методы
Изготовление постоянных препаратов (дополнительный материал – для ознакомления и в качестве справочника)
1.Фиксация. Фиксация – это сохранение материала в состоянии, близком к естественному. Для этого необходимо быстро умертвить ткани, что лучше всего достигается с небольшими кусочками живого материала. Используемое для этого вещество называется фиксатором. Быстрой фиксацией достигается сохранение изначальной структуры объекта, причем ткани уплотняются настолько, что с них можно готовить тонкие срезы.
2.Обезвоживание.Обезвоживание проводится при подготовке материала к заливке или для заключения его в соответствующую среду (см. ниже), которая не смешивается с водой. Воду необходимо удалить также потому, что иначе препарат будет со временем разрушен бактериями. Для того чтобы сохранить ультраструктуру, обезвоживание надо проводить постепенно, обрабатывая материал рядом водных растворов этанола или ацетона со все возрастающей концентрацией, и закончить обработку «абсолютным» (безводным) этанолом или пропанопом.
3.Просветление. Некоторые из часто применяемых сред для заливки и заключения не смешиваются со спиртом. Поэтому его надо постепенно замещать средой (просветляющим веществом), с которой заливочная среда смешивается, например ксилолом. Это приводит также к тому, что материал становится прозрачным.
4.Заливка. Для того чтобы с помощью микротома получить очень тонкий срез, необходимо, чтобы материал был залит в соответствующую опорную среду. При приготовлении препаратов для световой микроскопии объекты заливают в парафин, которому затем дают остыть. Для электронной микроскопии приходится использовать более твердые вещества (пластмассы или смолы), поскольку здесь необходимы особо тонкие срезы, а значит, и опора должна быть более плотной.
5.Изготовление срезов. Как правило, толщина кусочков материала слишком велика, чтобы сквозь них могло пройти достаточное для исследования под микроскопом количество света. Обычно приходится срезать очень тонкий слой исследуемого материала, т. е. готовить срезы. Срезы можно делать скальпелем, бритвой или на микротоме. Вручную срезы готовятся с помощью остро отточенной бритвы. Для работы на обычном микроскопе срезы должны быть толщиной 8- 12 мкм. Ткань закрепляют между двумя кусочками сердцевины бузины. Возможно использование кусочков плотной моркови. Бритву смачивают жидкостью, в которой хранилась ткань; срез делают через бузину (морковь) и ткань, причем бритву держат горизонтально и двигают ее к себе медленным скользящим движением, направленным чуть вкось. Быстро сделав несколько срезов, следует выбрать из них самый тонкий, содержащий характерные участки ткани.
Срез с ткани, залитой в ту или иную среду, можно сделать на микротоме. Для светового микроскопа срезы толщиной в несколько микрометров можно сделать с залитой в парафин ткани с помощью специального стального ножа. На ультратоме изготавливают чрезвычайно тонкие срезы (20-100 нм) для электронного микроскопа. В этом случае необходим алмазный или стеклянный нож.
6.Окрашивание. Как правило, биологические структуры на препаратах прозрачны, поэтому для получения контраста между ними приходится прибегать к различным средствам. Самым распространенным является окрашивание. Некоторые красители, используемые в световой микроскопии, перечислены в приведенной ниже таблице.
Определенные красители в низких концентрациях не токсичны для живых тканей и поэтому могут применяться для окрашивания живого материала. Их называют прижизненными (витальными) красителями. К ним относятся, например, метиленовый синий и нейтральный красный.
При окрашивании парафиновых срезов парафин удаляют с помощью растворителя, а срез частично обводняют.
| Красители, применяемые для окрашивания растительных и животных тканей | |||
| Краситель | Окончательный цвет | Окрашиваемый материал | |
| Постоянные красители | |||
| Анилиновый синий в лактофеноле | Синий | Гифы грибов и споры | |
| Борный кармин | Розовый | Ядра; особенно для крупных препаратов животного материала, например колонии Obelia | |
| Гематоксилин | Синий | Ядра; главным образом для срезов животных тканей в сочетании с эозином, окрашивающим цитоплазму; | |
| Краситель Лейшмана | Красно-розовый | Клетки крови | |
| Синий | Ядра лейкоцитов | ||
| Краситель Фёльгена (витальный) | Красный, пурпурный | ДНК; особенно хорошо выявляет хромосомы во время клеточного деления | |
| Метиленовый синий (витальный) | Синий | Ядра (раствор 0,125% метиленового синего в 0,75% NaCl) | |
| Сафранин | Красный | Ядра; лигнин и суберин у растений; используется для срезов растительных тканей в сочетании со светлым зеленым для окрашивания цитоплазмы | |
| Эозин | Розовый | Цитоплазма (см. гематоксилин) | |
| Красный | Целлюлоза | ||
| Светлый зеленый или прочный зеленый | Зеленый | Цитоплазма и целлюлоза (см. сафранин) | |
| Временные красители | |||
| Анилина гидрохлорид, сульфат анилина | Желтый | Лигнин | |
| Раствор йода | Сине-черный | Крахмал | |
| Раствор Шульца (хлор-цинк-йод) | Желтый | Лигнин, кутин, суберин, белок | |
| Синий | Крахмал | ||
| Синий или фиолетовый | Целлюлоза | ||
| Флороглюцинол + конц. HCI | Красный | Лигнин | |
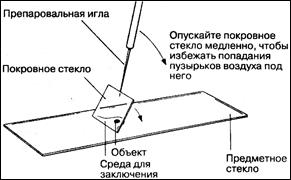
7.Заключение. Полностью окрашенные срезы заключают на предметном стекле в специальную среду, например в канадский бальзам или эупарол. Эта среда не пропускает воздух, так что срез может сохраняться в ней неограниченно долго. Заключенный в среду срез накрывают покровным стеклом.
Последовательность описанных выше действий типична, когда речь идет о приготовлении тонких срезов для постоянных препаратов. Однако часто в порядок действий вносят два следующих изменения:
а) если срез сырого материала готовят вручную, то сначала делают срез, а потом его фиксируют;
б) окрашивать можно после фиксации или же в процессе обезвоживания на какой-либо его стадии. Например, красителем, растворенным в 50%-ном этаноле, можно окрасить срез после его обезвоживания в 50%-ном этаноле.
Описанная процедура приготовления препаратов в основном сходна как для светового, так и для электронного микроскопов, хотя существуют некоторые различия в деталях (они перечислены в таблице).
| Различия в подготовке материалов для светового и электронного микроскопов | ||
| Обработка | Для светового микроскопа | Дня электронного микроскопа |
| Фиксация | а) этанол + ледяная уксусная к-та (99/1) или б) 70%-ный этанол (но в этом случае происходит сморщивание и повреждение тонких структур) | Часто используется глутаральдегид или смесь глутаральдегида и осмиевой кислоты (Os04). Os04 также окрашивает мембраны (липиды) в черный цвет. |
| Обезвоживание | Ряд растворов этанола или пропанона в возрастающей концентрации | |
| Заливка | Парафин | Смола (например, аралдит, эпон) или пластмасса |
| Приготовление срезов | Стальной нож микротома. | Только алмазный и стеклянный ножи ультратома. |
| Срезы толщиной в несколько микрометров | Срезы толщиной 20-100 нм | |
| Окрашивание | Цветные красители (отражают видимый свет) | Соединения тяжелых металлов – Os, U, Pb (отражают электроны) |
Временные препараты
Временные препараты для светового микроскопа в отличие от постоянных можно сделать сравнительно быстро. Они пригодны для проведения быстрых предварительных исследований. Материал для этого фиксируют, окрашивают и заключают в ту или иную среду. Срезы можно приготовить до фиксации или мацерации (древесину, например, мацерируют).
 1. Срез свежего материала можно сделать вручную с помощью бритвы непосредственно в 70%-ном этаноле, который служит фиксатором.
1. Срез свежего материала можно сделать вручную с помощью бритвы непосредственно в 70%-ном этаноле, который служит фиксатором.
2. Для окрашивания и заключения можно использовать ряд временных красителей. Каждый срез следует поместить на чистое предметное стекло (предварительно протертое спиртом) и капнуть на него несколько капель красителя. При окрашивании флороглюцинолом добавляют также одну каплю концентрированной соляной кислоты.
3. Затем препарат накрывают тонким покровным стеклом, чтобы предотвратить попадание воздуха и пыли и предохранить от загрязнения объектив большого увеличения.
4. Если образец начнет подсыхать или если заранее известно, что потребуется длительное изучение (более 10 мин), то после окрашивания препарат следует заключить в глицерол.
Фракционирование клеток
Когда речь идет о выявлении функций отдельного органоида, необходимы дополнительные методы исследования. Обычно, для этого нужно отделить его от других клеточных компонентов и заставить выполнять свою функцию in vitro.
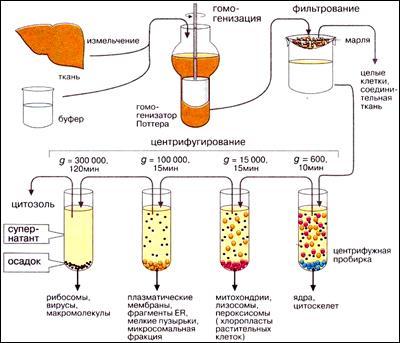
Для того чтобы выделить клеточные органоиды, исследуемый образец измельчают и затем гомогенизируют,поместив их в подходящую среду (буферный раствор) с надлежащим рН, ионным составом и температурой. Для выделения интактных органоидов крайне важно, чтобы среда, в которой проводится гомогенизация, была изотонической, т.е. осмотическое давление буферного раствора должно соответствовать давлению внутри клетки. Если раствор гипотоничен, органеллы будут «впитывать» дополнительную воду и лопнут, а в гипертонических растворах они, напротив, сморщиваются. Гомогенизация обычно проводится с использованием гомогенизатора Поттера-Элведжема (тефлоновый пестик, вращающийся в стеклянном цилиндре), но можно это проделать и с помощью обычного миксера.
Вслед за гомогенизацией следует фильтрованиечерез марлю для удаления сохранившихся клеток и волокон соединительных тканей.
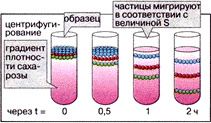 Полученный гомогенат подвергают центрифугированию. Зачем?
Полученный гомогенат подвергают центрифугированию. Зачем?
Частицы в растворах осаждаются, когда их плотность выше плотности раствора (седиментация), остаются неподвижными, если плотности частиц и раствора одинаковые, или всплывают, когда их плотность ниже плотности раствора (флотация). Чем больше разница в плотности, тем быстрее идет распределение частиц (рисунок справа).
Макромолекулы или органоиды, незначительно различающиеся по размеру или по плотности, можно разделить только центрифугированием в растворе определенной плотности.
Возникающая в центрифуге центробежная сила обычно выражается числом, кратным ускорению свободного падения g (g = 9,81 м/с2). Величины до 10 000g получают с помощью простой настольной центрифуги, высокоскоростные рефрижераторные центрифуги позволяют достичь 50 000g, а стационарные ультрацентрифуги, работающие с охлаждением и в вакууме, – 500 000g.
Скорость оседания частицы (V) зависит от угловой скорости вращения ротора (ω), эффективного радиуса ротора (rэфф – расстояние от оси вращения) и коэффициента седиментации частицы выражаемого в Сведбергах (S).
Коэффициент седиментации частицы – скорость ее оседания при эталонных значениях плотности буфера, угловой скорости ротора и его эффективного радиуса.
 Коэффициент седиментации характеризует саму частицу, поскольку зависит от ее молекулярной массы, плотности, формы и проч. Казалось бы, причем здесь форма?
Коэффициент седиментации характеризует саму частицу, поскольку зависит от ее молекулярной массы, плотности, формы и проч. Казалось бы, причем здесь форма?
Возьмем две одинаковые по массе свинцовые дробинки и расплющим одну из них молотком до состояния относительно тонкой фольги. Что изменилось? Масса осталась прежней, плотность свинца при данной температуре постоянна. Однако в вязкой жидкости расплющенная дробинка будет оседать медленнее, чем округлая. При изменении формы увеличилась площадь поверхности, что привело к увеличению силы трения.
Чем больше число оборотов центрифуги, тем более мелкие частицы осаждаются. Центрифугирование проводят в несколько приемов, постепенно увеличивая скорость. После каждого центрифугирования надосадочную жидкость (супернатант) отделяют от осадка, чтобы вновь подвергнуть ее центрифугированию. Каждый последующий осадок содержит все более мелкие органеллы. Такая методика известна как дифференциальное центрифугирование.
Последовательность и условия седиментации различных органоидов при дифференциальном центрифугировании приведены на схеме справа.
Выделение клеточных органелл обычно проводят при низких температурах (0-5°С) для того, чтобы уменьшить степень деградации материала за счет реакций, катализируемых ферментами; последние высвобождаются в процессе разрушения ткани.
Дополнительный (справочный) материал
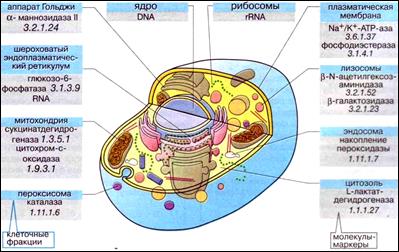
В процессе фракционирования важно контролировать чистоту фракций. Присутствие в определенной фракции той или иной органеллы и наличие других компонентов определяют с помощью молекул-маркеров. Обычно это ферменты специфичные для данного органоида (ферменты-маркеры). Распределение ферментов-маркеров в клетке отражает локализацию в ней соответствующих каталитических реакций.
Метод меченых атомов.
Метод меченых атомов применяют при изучении биохимических процессов, происходящих в живых клетках. Чтобы проследить за превращениями какого-либо вещества, в его предшественнике заменяют один из атомов соответствующим радиоактивным изотопом (3Н, 32Р, 14С и др.).
Как известно, по химическим свойствам изотопы одного и того же элемента не отличаются друг от друга, но зато радиоактивный изотоп сигнализирует о своем местонахождении радиоактивным излучением. Это позволяет проследить за определенным соединением, установить последовательность этапов его химических превращений, продолжительность их во времени, зависимость от условий и т. д.
Флуоресцентная микроскопия.
Нередко живые клетки наблюдают в ультрафиолетовом свете. При этом одни клеточные компоненты начинают сразу светиться (флуоресцировать), другие светятся лишь при добавлении специальных красителей. Флуоресцентная микроскопия позволяет увидеть места расположения нуклеиновых кислот, витаминов, жиров и др.
Многообразие форм жизни на клеточном уровне (предварительное знакомство).
Органический мир отличается чрезвычайным разнообразием форм. По уровню организации все организмы часто подразделяют на две группы: вирусы («доклеточные», а почему в кавычках – см. далее) и клеточные. Изучение клеток разнообразных организмов показало, что по своему строению они разделяются на две группы – прокариоты и эукариоты.
Группу прокариотов составляют архебактерии и эубактерии (включая цианей). Эти организмы имеют наиболее простое строение клеток: у них нет оформленного ядра и многих органоидов (структурных компонентов цитоплазмы).
Другую группу составляют все остальные организмы: грибы, растения, животные (в том числе и человек). Они имеют сложно устроенные клетки, которые называют эукариотическими. Эти клетки имеют ядро и органоиды, выполняющие специфические функции. На сегодняшний день изучено более 3000 видов вирусов, около 4 000 видов прокариот и свыше 2 млн. видов эукариот.
