Трансляция генетического кода
Трансляция - это процесс декодирования мРНК, в результате которого информация с языка последовательности нуклеотидов в мРНК переводится (транслируется) на язык последовательности аминокислота в полипептидной молекуле. Декодирование мРНК осуществляется в направлении 5' —> 3'.
В процессе трансляции различают стадии:
1) активация аминокислот;
2) аминоацилирование тРНК;
3) собственно трансляция.
Активация аминокислот. Это процесс присоединения аминокислоты с помощью своей карбоксильной группы к α-фосфату АТР с помощью специфической аминоацил-тРНК-синтетазы. Реакция сопровождается высвобождением неорганического пирофосфата и образованием аминоацил-аденилата (АК-АМР). Аминоацил-аденилат обладает очень высокой реакционной способностью и стабилизируется благодаря прочному связыванию с ферментом. Данный процесс характеризуется высокой специфичностью: для каждой аминокислоты существует собственный фермент (ферменты).
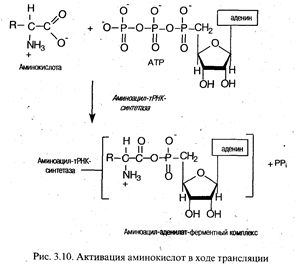
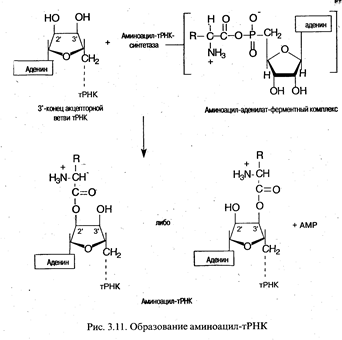
Аминоацилирование тРНК. Представляет собой перенос аминоацильной группы от связанного с ферментом аминоацил-аденилата на 2'- или 3'-ОН-группу концевой рибозы тРНК в акцепторной ветви.
Ключевой особенностью реакции, приводящей к аминоацилированию тРНК, является специфичность участвующих в ней ферментов. Присоединение к тРНК каждой из 20 аминокислот, встречающихся в белках, катализируется определенной аминоацил-тРНК-синтетазой. Фермент должен отличить одну аминокислоту от 19 других и перенести ее к одной или нескольким изоакцепторным тРНК из имеющихся примерно 75 других тРНК. При этом следует подчеркнуть высокое сходство в структуре многих аминокислот (лейцин, валин и изолейцин; аспарагиновая и глутаминовая кислоты и др.), а также удивительное сходство вторичной и третичной структур тРНК. Поэтому даже очень высокой специфичности, присущей данным ферментам, оказывается недостаточно, чтобы не допустить ошибок, и синтетазы могут исправлять ошибки, происходящие при присоединении. Это имеет место при гидролизе связи между аминокислотой и AMP в комплексе фермент-аминоацил-аденилат. В таком случае формирование ошибочно аминоацилированной тРНК предотвращается. Напротив, механизм, с помощью которого удалялась бы уже присоединенная к тРНК неправильная аминокислота, отсутствует. В таких случаях аминокислота занимает неправильную позицию в белке. Частота таких ошибок очень низка (например, в гемоглобине кролика 10-5).
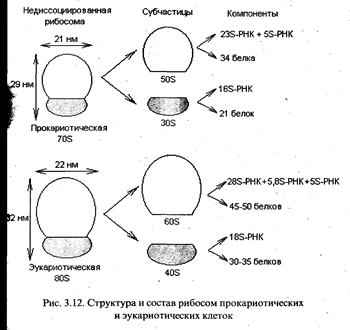
Собственно трансляция. Процесс трансляции осуществляется на рибосомах - клеточных органеллах, представляющих собой сложный комплекс из белков и молекул РНК. В течение всего процесса синтеза белка растущая полипептидная цепь, мРНК и очередная аминоацил-тРНК остаются прикрепленными к рибосоме. У прокариот и эукариот рибосомы различаются по величине и составу (рис. 3.12). Коэффициент седиментации рибосом прокариот составляет 70S (S - Сведберг, единица измерения скорости, с которой частица оседает при центрифугировании; IS = 10 -13 с), а у эукариот для рибосом, обнаруживаемых в цитоплазме, он равен 80S.
Рибосомы при определенных условиях могут диссоциировать на большую и малую субчастицы, а каждая субчастица, в свою очередь, на составляющие молекулы белка и РНК (рис. 3.12). Все эти компоненты могут снова ассоциировать с образованием функционально активной рибосомы, если созданы соответствующие условия.
Электронно-микроскопические исследования 705-рибосом показали, что малая и большая субчастицы соприкасаются в нескольких точках, причем между ними образуется бороздка, необходимая для размещения мРНК во время трансляции. Для понимания процесса трансляции важны два основных в функциональном отношении участка на 70S-рибосоме. Участок (сайт) А служит для присоединения аминоацил-тРНК, а с сайтом Р связывается растущая пептидная цепь.
В процессе трансляции, кроме аминоацил-тРНК и рибосом, принимает участие большое количество вспомогательных белков - факторов инициации, элонгации и терминации транскрипции.
Суть процесса трансляции состоит в последовательном декодировании мРНК в направлении 5' —> 3' с помощью аминоацилированных тРНК, в ходе которого происходит последовательная конденсация аминокислотных остатков, начиная с амино-(N)-конца полипептидной цепи, в направлении к карбоксильному (С)-концу. Матричный принцип процесса соблюдается при узнавании комплементарных нуклеотидов в составе очередного кодона мРНК и антикодона тРНК. Наиболее полно трансляция изучена у прокариот, и механизм этого процесса будет рассмотрен на примере трансляции у Е. сой.
Инициация трансляции. Считывание мРНК начинается с кодона AUG, который обозначает 5'-конец кодирующей последовательности и детерминирует N-концевую (первую) аминокислоту синтезируемого полипептида. Для инициации трансляции необходимо наличие 30S-субчастицы рибосомы, которая связывается в комплекс с белками - факторами инициации (IF1, IF2, IF3), GTP и Fmet-тРНК. Такой полный комплекс связывается с 5'-концом кодирующей последовательности мРНК вблизи кодона AUG. Очевидно, IF2 способен отличить Fmet-тРНК (формил-метионин-тРНК) от met-тРНК, которая связывается с кодонами AUG во внутренней части мРНК, но не может начать трансляцию со стартового кодона AUG. Эта специфичность обеспечивается N-формильной группой, отсутствующей у met-тРНК.
Распознавание стартового кодона осуществляется следующим образом. Связывание 30S-субчастицы с мРНК находится под строгим контролем нуклеотидной последовательности, расположенной примерно за 10 нуклеотидов до 5'-конца стартового кодона. Взаимодействию способствует комплементарное спаривание этой богатой пуринами последовательности с полипиримидиновым участком, находящимся в составе 16S-pPHK. Процесс инициации зависит от многих условностей в структуре взаимодействующих участков, в том числе от вторичной структуры того участка молекулы мРНК, в котором находится стартовый кодон AUG. Это имеет значение для процессов регуляции эффективности синтеза белка.
Итак, при инициации указанный комплекс связывается с Р-сайтом 30S-субчастицы рибосомы, и первой аминокислотой в составе пептида будет формил-метионин. Далее следует присоединение 50S-субчастицы рибосомы и формируется 70S-инициирующий комплекс (рис. 3.13). Источником энергии для инициации синтеза белка служит расщеплениеGTP доGDP и Pi.
Элонгация трансляции. Для образования первой пептидной связи необходимо, чтобы аминоацил-тРНК, соответствующая следующему кодону, заняла А-участок рибосомы. Для этого аминоацил-тРНК должна сначала связать белок EF-Tu (один из факторов элонгации) и GTP. Образовавшийся тройной комплекс (аминоацил-тРНК- [EF-Tu-GTP]) и доставляет аминоацил-тРНК к А-участку. GTP в это время гидролизуется, и комплекс (EF-Tu-GDP) отделяется от рибосомы. Когда оба участка, А и Р, заняты, пептидилтрансферазная активность 50S-субчастицы катализирует перенос группы Fmet с ее тРНК на аминогруппу аминоацил-тРНК, находящуюся в А-участке (рис. 3.14). В результате в А-участке оказывается дипептидил-тРНК, а в Р - свободная тРНК (рис. 3.13).
Пептидилтрансферазная активность рибосом связана, по-видимому, не с белковой частью 50S-субъединицы, а с одним из РНК-компонентов - рибозимов.
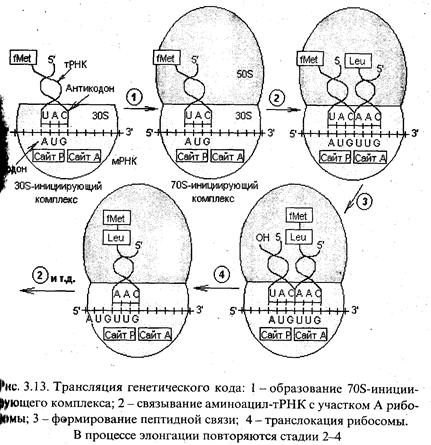
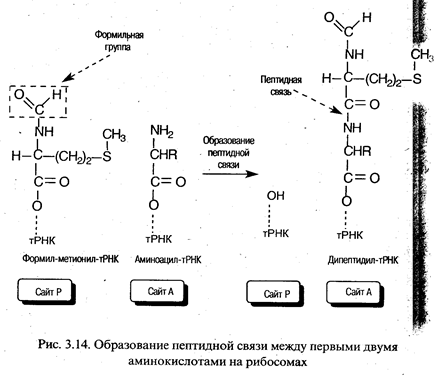
Для прочтения следующего кодона и удлинения полипептидной цепи еще на одну аминокислоту вся серия реакций должна повториться. Однако прежде чем это произойдет, свободная тРНК освобождает Р-участок, образовавшаяся дипептидил-тРНК перемещается на него с А-участка (при этом не происходит взаимодействия кодона с антико-кодоном), а рибосома продвигается скачкообразно (на 3 нуклеотида) в сторону З'-конца мРНК. Все эти процессы осуществляются с помощью фактора элонгации EF-G при GTP-зависимойтранслокации рибосомы. В результате этих трех актов освобождается участок А и экспонируется следующий кодон, что позволяет начаться следующему циклу элонгации (рис. 3.13). Следует отметить, что при образовании каждой пептидной связи расходуется энергия, равная четырем энергетическим эквивалентам (если за один эквивалент принять энергию образования фосфатной связи): два эквивалента АТР потребляются при аминоацилировании тРНК и два эквивалента GTP - в каждом цикле элонгации.
Терминация трансляции. Процесс последовательной трансляции кодонов, в конце концов, доходит до того момента, когда в А-участке оказывается один из трех терминирующих кодонов - UAG, UAA или UGA. В природе не существует таких тРНК, антикодоны которых соответствовали бы этим кодонам. Здесь вступают в действие факторы терминации - RF-1 и RF-2, которые катализируют отсоединение полипепидной цепи от тРНК, тРНК - от рибосомы, а 70S-рибосомы - от мРНК.
После инициации трансляции 70S-рибосома удаляется от сайта инициации по мере считывания каждого последующего кодона. Когда расстояние от рибосомы до сайта инициации достигнет величины 100-200 нуклеотидов, в этом сайте может произойти новая инициация. Более того, как только вторая рибосома пройдет такое же расстояние, может произойти третья инициация, и т. д. Итак, одну и ту же белок-кодирующую последовательность мРНК могут одновременно транслировать несколько рибосом. Подобные мультирибосомные трансляционные комплексы называются полирибосомами илиполисомами.
Матричные РНК, состоящие из нескольких белок-кодирующих участков, часто транслируются последовательно: когда рибосома доходит до терминирующего кодона в первой последовательности, она отделяется от мРНК и со следующим инициирующим участком связывается новый комплекс. Иногда этого не происходит, и транслирующая первую кодирующую последовательность рибосома, не отделяясь, перемещается вдоль мРНК, инициируя трансляцию в других сайтах.
Особенности трансляции у эукариот. Процесс трансляции эукариотической мРНК в основном аналогичен таковому для прокариот. Однако имеется ряд отличий. Во-первых, процессы транскрипции и трансляции у эукариот разобщены во времени и в пространстве, поскольку транскрипция осуществляется в ядре, а трансляция - в цитоплазме. Во-вторых, инициирующей аминоацил-тРНК у эукариот служи г не Fmet-тРНK, а специальная инициирующая met-тРНК. В-третьих, на 5'- и З'-концах эукариотичеких мРНК имеются особые структуры «кэпы» и «шлейфы», принимающие участие в трансляции. Известно, что отдельные факторы инициации трансляции узнают кэпированные области для связывания с мРНК и начала процесса трансляции.
Биосинтез белка
1. Строение рибосомы
2. Свойства генетического кода
3. Этапы синтеза белка, необходимые факторы и их роль
В соответствии с основным постулатом молекулярнойбиологиисинтез белков включает три процесса. Транскрипция —синтез информационной (матричной) РНК на ДНК-матрицена основе комплементарности. Это переписывание генетической информации с ДНК на РНК. В молекуле мРНК записана информация о последовательности аминокислот в первичной структуре белка с помощью триплетного нуклеотидного кода. У эукариот процесс идет в ядре.
Трансляция — перевод генетической информации мРНК, записанной с помощью четырех нуклеотидов, в первичную структуру белка (полипептид), записанную с помощью 20 аминокислот. Процесс идет в рибосомах. Для осуществления перевода нуклеотидного кода в аминокислотную последовательность существуют специальные молекулы-адаптеры. Роль адаптеров выполняют тРНК: с одного конца молекулы — аминокислота (З'-конец тРНК), а с другого — антикодон, т.е. триплет нуклеотидов, комплементарный кодону мРНК. В результате транскрипции и трансляции генетическая информация ДНК реализуется в виде первичной структуры белка.
Посттрансляционная модификация белков осуществляется в цитозоле, аппарате Гольджи и других местах клетки за счет специфического взаимодействия радикалов аминокислот первичной структуры и других молекул. При этом формируется нативная структура белка.
Рибосомы. Внутриклеточный компонент, в котором осуществляется процесс трансляции, называется рибосомой. Множество рибосом могут одновременно транслировать одну и ту же цепь мРНК, образуя так называемые полирибосомы (полисомы). Шероховатый эндоплазматический ретикулум — это компартмент клетки, в котором мембрансвязанные полисомы продуцируют как мембранные белки, так и белки, подлежащие экскреции и транспорту. Полирибосомные структуры присутствуют и в свободной форме — в цитозоле, где они синтезируют внутриклеточные белки. Рибосомы — это субклеточные частицы, состоящие из рРНК и белков. По константе седиментации различают 70S-рибосомы прокариот и 80S-рибосомы эукариот. Соотношение рРНК и белков у 70S-рибосом — 2:1, а у 80S-рибосом — 1:1. Рибосомные РНК синтезируются в ядрышке в виде предшественника 45S-рРНК, который затем расщепляется эндонуклеазами на рРНК нужной длины. Рибосомные белки образуются в цитоплазме и переносятся в ядрышко. Здесь спонтанно образуются рибосомные субъединицы путем объединения белков с соответствующими рРНК. Возникшие большая (50S — у прокариот и 60S — у эукариот) и малая (30S — у прокариот и 40S — у эукариот) субъединицы рибосом через поры ядерной оболочки переносятся в цитозоль. Большая субъединица рибосом эукариотической клетки содержит 41 белок, 5S-, 5,8S- и 28S-pPHK; малая — 30 белков и 18S-рРНК. В микробной клетке количество рибосом равно 10 000, а в эукариотической — достигает 100 000. Согласно представлениям Дж. Уотсона, существует «рибосомный цикл»: в начале синтеза полипептидной цепи субъединицы рибосомы объединяются в функционирующую рибосому на мРНК для осуществления трансляции, а в конце синтеза диссоциируют.
Генетический код. Информация о последовательности аминокислот в полипептидной цепи записана на мРНК в виде трехбуквенного нуклеотидного кода.
Основные свойства кода: триплетность — каждая аминокислота кодируется тройкой нуклеотидов, называемой кодоном; вырожденность — одну и ту же аминокислоту может кодировать несколько кодонов, причем важнейшую роль играют дня первых нуклеотида триплета; однозначность — каждому триплету соответствует только одна аминокислота; неперекрываемость — кодоны считываются один за другим не перекрываясь; универсальность — соответствие аминокислот триплетному коду у всех живых организмон (в последние годы показано, что в митохондриях различных клеток четыре кодона считываются иначе, чем постулировано принципом универсальности).
Среди 64 триплетов мРНК выделяют три типа:
1) инициирующие — АУГ и ГУГ (кодируют включение формилметионина у прокариот или метионина у эукариот), определяют стадию начала (инициации) синтеза белковой молекулы; 2) смысловые кодируют включение аминокислот в синтезируемую полипептиднуш цепь; 3) терминирующие — не кодируют включение аминокислот, это нонсенс-кодоны, которые определяют завершение (терминацию) синтеза полипептидной цепи.
Этапы синтеза белка и необходимые факторы. По А. Ленинджеру, выделяют пять этапов синтеза белковой молекулы: 1) активация аминокислот с образованием аминоацил-тРНК; 2) инициации полипептидной цепи; 3) элонгация полипептидной цепи; 4) терминация полипептидной цепи и освобождение; 5) сворачивание полипептидной цепи и процессинг (созревание).
Белоксинтезирующая система клетки должна иметь:
1) матрицу мРНК, на которой записана информация о последовательности аминокислотных остатков в синтезируемой полипептидной цепи,
2) рибосомы — субклеточные частицы, осуществляющие ферментативный синтез полипептидной цепи по матрице мРНК (точнее — полирибосома, являющаяся комплексом мРНК и рибосом);
3) набор всех типов аминоацил-тРНК. (набор молекул-адаптеров); различные регуляторные и вспомогательные факторы белковой природы;
4)АТФ, ГТФ, ионы магния и др.
Трансляция молекул мРНК начиняется с 5'-конца с образованием N-конца растущей полипептидной цепи. Информация считывается в направлении 5' —> 3' и заканчивается образованием С-конца белковой молекулы. Транскрипция гена в соответствующую мРНК начинается с образования 5'-конца молекулы мРНК. У прокариот это позволяет начать трансляцию мРНК еще до завершения транскрипции. У эукариот процесс транскрипции происходит в ядре, а трансляции мРНК — в цитоплазме. Такая компартментализация процессов исключает одновременное протекание транскрипции и трансляции и делает неизбежным процессинг предшественников мРНК — гяРНК.
Активация аминокислот. В цитоплазме клеток 20 различных аминокислот присоединяются эфирной связью к соответствующей т-РHK с образованием аминоацил-тРНК. Этот процесс катализируется высокоспецифичными аминоацил-тРНК-синтетазами:
аминокислота + тРНК + АТФ -> аминоацил-тРНК + АМФ + РРн.
Многие аминоацил-тРНК-синтетазы способны исправлять ошибки при присоединении близких по структуре аминокислот. Например, при включении валина вместо изолейцина (различие на одну метиленовую группу) фермент способен распознать ошибку, когда аминокислота поступает в активный центр, и гидролитически отщепить неправильную аминокислоту. Именно поэтому в этих ферментах выделяют четыре важных для катализа места связывания: для аминокислоты, тРНК, АТФ и для воды (гидролиз «неправильных» аминоацил-тРНК).
Инициация полипептидной цепи. Для инициации полипетидной цепи в клетках прокариот необходимы: мРНК, инициирующая аминоацил-тРНК, малая и большая субъединицы рибосом. Они собираются в работающий ансамбль с помощью трех белков (факторы инициации) IF-1, IF-2, IF-3, ионов магния и ГТФ. Инициирующая аминоацил-тРНК у прокариот представлена формилметионин-тРНК, а у эукариот — метионин-тРНК. Стадия инициации начинается с присоединения IF-3к малой субъединице рибосомы. Этот фактор обеспечивает узнавание на мРНК участка для присоединения инициирующей тРНК, т.е. инициирующего кодона (АУГ, ГУГ). В это же время инициирующая формилметионин-тРНК связывается с IF-2 и ГТФ. Затем оба комплекса взаимодействуют и образуется инициирующий комплекс, который связывается с мРНК. Это связывание происходит с помощью фактора IF-1, который способствует соединению мРНК с инициирующим комплексом, состоящим из малой субъединицы, формилметионин-тРНК, IF-2, IF-3, ГТФ. Белковый фактор IF-2 способствует соединению большой и малой субъединиц рибосомы. После присоединения большой субъединицы высвобождаются все инициирующие факторы, ГДФ и неорганический фосфат, т.е. процесс идет с затратой энергии. Смысл всех этих операций заключается в том, что мРНК соединяется с инициирующей (формил)метионин-тРНК в рибосоме единственно возможным способом, определяющим точное положение рамки считывания кодонов мРНК на инициирующем кодоне.
В работающей рибосоме есть два участка связывания транспортных РНК (тРНК): А-участок (аминоацильный), имеющий сродство к аминоацил-тРНК, и Р-участок (пептидильный), имеющий сродство к пептидил-тРНК. В конце стадии инициации инициирующая (формил)метионин-тРНК находится в Р-участке собранной рибосомы и соединена водородными связями с инициирующим кодоном мРНК. В А-участке находится следующий кодон мРНК.
Элонгация полипептидчой цепи. Для осуществления элонгации необходимы: набор аминоацил-тРНК, ГТФ, ионы магния, факторы элонгации — EF-T и EF-g. Она начинается с присоединения аминоацил-тРНК к следующему за инициирующим кодону мРНК в А-участке рибосомы. Каждое присоединение аминоацил-тРНК требует затраты молекулы ГТФ и происходит при участии EF-T. Между кодоном мРНК и антикодоном аминоацил-тРНК замыкаются водородные связи. Когда два аминокислотных остатка оказываются рядом, между ними образуется водородная связь. Процесс катализируется рибосомным ферментом пептидилтрансферазой и использует энергию макроэргической связи аминоацил-тРНК. Образовавшийся дипептид силами гидрофобного взаимодействия радикалом связан с Р-участком. В то же время он связан с тРНК, находящейся в А-участке и связанной с кодоном мРНК. Сродства к А-участку эта пептидил-тРНК не имеет. При участии EF-g и за счет энергии ГТФ происходит перемещение пептидил-тРНК в Р-участок, а вместе с ней и кодона мРНК, так как они связаны водородными связями. Фактор EF-g считают ГТФазой. Такое перемещение называют транслокацией. (Формил)метионин-тРНК при этом высвобождается из рибосомы. В результате транслокации в А-участок рибосомы приходит новый кодон мРНК. К нему методом случайного подбора присоединяется комплементарным антикодоном новая аминоацил-тРНК. Между дипептидом Р-участка и аминокислотным остатком в А-участке замыкается пептидная связь. Возникший трипептид транслоцируется в Р-участок, а в А-участок приходит следующий новый кодон мРНК и т.д. Таким образом, происходит многократное повторение этапов элонгации, пока в А-участок не придет один из терминирующих кодонов.
Терминация полипептидной цепи. Необходимые факторы: FR-1 воспринимает триплеты УАА и УАГ; FR-2 воспринимает УАА и УГА; ГТФ. Терминирующие кодоны (бессмысленные, нонсенс-кодоны) не имеют для себя аминоацил-тРНК. Кодоны, поступив в А-участок, воспринимаются факторами FR-1 или FR-2, которые индуцируют пептидилэстеразную активность, вследствие чего отщепляется синтезировавшийся полипептид. Весь комплекс трансляции диссоциирует на составные части.
В цитоплазме клеток прокариот с помощью фермента деформилазы происходит отщепление формильной группы от N-концевого формилметионина синтезированного полипептида; часто после завершения синтеза в цитоплазме клеток отщепляется N-концевой метионин от синтезированного полипептида (у прокариот и эукариот). На основе взаимодействия радикалов аминокислотных остатков полипептидной цепи спонтанно формируются вторичная, третичная, а у олигомерных белков и четвертичная структуры.
Посттрансляционная модификация белка включает следующие процессы: химическую модификацию белка (часто отсутствует) — метилирование по аминогруппе лизина и аргинина, фосфорилирование по ОН-группе серина, окисление лизина, пролина и др.; связывание простетической группы; связывание между собой субъединиц олигомерного белка; частичный протеолиз.
Например, посттрансляционная модификация при биосинтезе гликопротеинов происходит следующим образом. Полисомы связаны с внешней поверхностью мембраны эндоплазматического ретикулума клеток через большую субъединицу рибосомы. Синтезированные полипептидные цепи проходят через мембрану шероховатого эндоплазмати-ческого ретикулума в цистерны и переносятся в гладкий эндоплазматический ретикулум и в комплекс Гольджи. Здесь с помощью гликозилтрансфераз происходит присоединение моносахаридных молекул к полипептидным цепям с образованием гликопротеинов.
Регуляция биосинтеза белков. В настоящее время считают, что регуляции подвержены все или почти все этапы биосинтеза белков. Например, метаболиты и гормоны могут изменять сродство белков-репрессоров к регуляторным отделам ДНК; гормоны способны модифицировать активность метилаз, участвующих в биосинтезе рРНК; новообразованные белки способны активировать рибонуклеазы и тем самым ускорять распад своих мРНК и т.п.
Согласно теории Жакоба и Моно, в биосинтезе белков у бактерий участвуют три типа генов: структурные гены, ген-оператор и ген-регулятор. Структурные гены определяют первичную структуру белков. Функционирование структурных генов контролируется геном-оператором (локализован между промотором и структурными генами). Формирование мРНК начинается с промотора и далее распространяется вдоль оператора и контролируемых им структурных генов. Оператор и структурные гены называют опероном. Деятельность оперона контролируется геном-регулятором. Оперон и ген-регулятор находятся в разных участках цепи ДНК, поэтому связь между ними осуществляется с помощью белка-репрессора, синтезируемого по информации гена-регулятора. Если репрессор связан с геном-оператором, то РНК-полимераза не может синтезировать мРНК, а следовательно, не синтезируются и белки. Если ген-оператор свободен, процесс транскрипции возможен и информация структурных генов используется для синтеза белков.
Рассмотрим превращения:
Е' Е2 Е3
A->B->C->D
Чтобы исходное вещество А превратилось в конечный продукт D, необходимы ферменты Е1,2,3. Если это неразветвленный процесс, то синтез этих ферментов кодируется одним опероном.
Установлено, что при отсутствии вещества А репрессор связан с геном-оператором и синтез белков-ферментов Е1,2,3 не идет. При появлении метаболитов возможны два варианта:
1) индукция синтеза ферментов. Исходное вещество А, подлежащее превращениям, понижает сродство репрессора к гену-оператору. В результате РНК-полимераза осуществляет синтез мРНК. Затем синтезируются белки-ферменты Е1,2,3. Они обеспечивают превращения вещества А в D;
2) репрессия синтеза ферментов. Конечные продукты реакции (их называют корепрессоры) повышают сродство репрессора к гену-оператору. Это приводит к блокировке гена-оператора, и матричный синтез мРНК прекращается, что сопровождается подавлением синтеза белков Е1,2,3.
Регуляция синтеза белков в клетках эукариот намного сложнее, так как:
· не характерна прямая субстратная регуляция, так как опероны (транскриптоны) имеют обширные регуляторные зоны;
· структурные гены разбросаны по геному;
· в ядрах дифференцированных клеток эукариот большинство генов находится в репрессированном состоянии;
· все структурные гены делят у эукариот на три группы — гены, функционирующие во всех клетках организма, в тканях одного типа, и специализированных клетках одного типа;
· пространственное разделение процессов — транскрипция в ядре, трансляция в рибосомах.
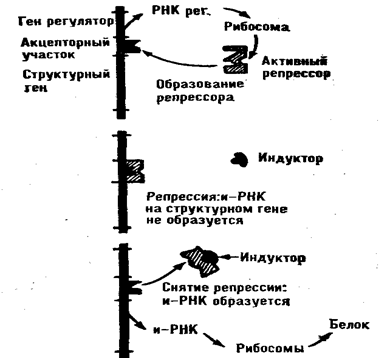
В молекуле ДНК-матрицы имеется особый участок — промотор, — с которого РНК-полимераза начинает синтез РНК, а также участок, сигнализирующий о завершении процесса. На стадии транскрипции действуют некоторые тонкие механизмы регуляции белкового синтеза. Существует два вида воздействия на белковый синтез: репрессия (подавление) и индукция (yсиление) его. Как уже отмечалось, в молекулах ДНК содержат регуляторные гены. Они кодируют аминокислотную последовательность специфических белков — репрессоров, многие из которых являются гистонами. Репрессор в обычном порядке синтезируется в рибосомах и затем связывается с молекулой ДНК на так называемом акцепторном участке, расположенном непосредственно рядом со структурными генами. Такое связывание мешает РНК-полимеразе синтезировать и-РНК на поверхности структурного гена. В молекуле репрессора есть особый центр связывания с ДНК, пространственная структура которого может меняться в зависимости от внешних воздействий. Если в клетке появляется вещество-индуктор, то, присоединяясь в репрессору, оно так изменяет структру этого центра, что связывание становится невозможным и РНК-полимераза начинает синтезировать и-РНК на структурных генах (рис. 74). Имеются сведения об индукции белкового синтеза гормонами. Таким действием обладают некоторые стероидные гормоны надпочечников, тироксин и ряд других. Во многих случаях белки-репрессоры теряют способность подавлять синтез и-РНК, образуя соединения с фосфорной кислой. Мощными активаторами фосфорилирования репрессорных белков являются ц-АМФ и ц-ГМФ.
 -
-
Схема действия индуктора
В некоторых случаях репрессор сам по себе мало активен. Для подавления белкового синтеза ему нужен корепрессор. Это метаболит, присоединение которого к репрессору изменяет структуру центра связывания так, что репрессор становится способным реагировать с акцепторным участком ДНК и тормозить синтез и-РНК на структурных генах (рис. 75).
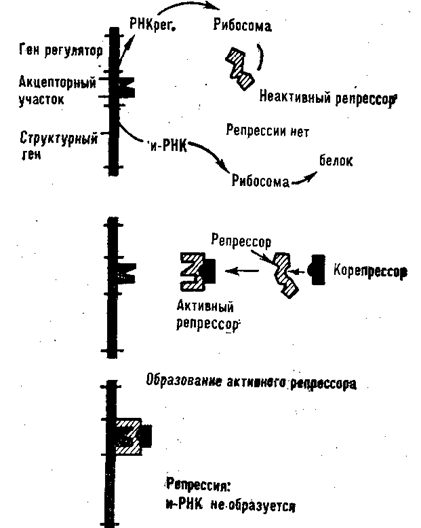
Схема действия корепрессора
