Дослід № 1. Полімеразна ланцюгова реакція (ПЛР).
ПЛР – це високоспецифічний метод експрес–діагностики, що дозволяє множити певні нуклеотидні послідовності до утворення необмеженого числа копій генів в таких кількостях, які можна виявити методом молекулярної гібридизації за допомогою електрофорезу.
Принцип методу. ПЛР базується на багатократному повторюванні циклів синтезу (ампліфікації) специфічної ділянки ДНК–мішені з дезоксинуклеозидтрифосфатів у присутності термостабільної ДНК–полімерази, відповідного сольового буфера та олігонуклеотидних затравок–праймерів, що визначають кордони ампліфікованої ділянки ДНК-мішені. Для діагностики інфекційного захворювання підбираються системи праймерів, комплементарних специфічним для збудника ділянкам генів, які дозволяють ампліфікувати фрагмент, що має для кожної системи праймерів свою довжину.
Матеріальне забезпечення:1) Обладнання: прилад ампліфікатор (забезпечує досліджуваним зразкам проходження необхідної кількості циклів, що включають: денатурацію ДНК при температурі 94±2˚С; відпалювання праймерів при температурі від 50 до 65˚С; синтез при температурі 72±2˚С; точність температурного режиму <0,5˚С; швидкість переходу температури >1,5˚С/с; тривалість циклів від 1 с до 4 хв та їх кількість – до 40); автоматичні мікропіпетки на 10 і 20 мкл з точністю до 0,5 мкл; пластикові пробірки на 0,2; 0,5 та 1,5 мл; одноразові наконечники до мікропіпеток; мікроцентрифуга; вортекс; апарат для електрофорезу ДНК в агарозному гелі; джерело постійного електричного струму (V – 50-250В, I – до 50мА); трансілюмінатор з фільтром на 310 нм; ламінарний бокс або бокс для ПЛР; фотоапарат з приставкою для реєстрації результатів ПЛР.
2) Реактиви: Для виділення ДНК з досліджуваних зразків застосовують фенольний або гуанідиновий методи. Використовують такі набори реагентів:
1. Набір для виділення ДНК із біопроб на 100 зразків (зберігають при +4˚С) : розчин І (лізуючий) 30мл, розчин ІІ (промивний) 10 мл, розчин ІІІ (промивний) 200 мл, сорбент 1000 мкл, ТЕ-буфер 5мл.
2. Набір для виділення ДНК/РНК із сироватки та плазми крові на 100 зразків (зберігають при +4˚С) : денатуруючий розчин – 45 мл, ізопропіловий спирт – 30 мл, промивний розчин – 100 мл, розчин носія – 300 мкл, вода дейонізована – 3 мл, хлороформ – 12 мл.
3. Набір для проведення ПЛР на 110 визначень (зберігати при температурі – 20˚С): реакційна суміш 300 мкл, Тад-полімераза (5 од/мкл) 25 мкл, вода дейонізована –2 мл, масло вазилінове – 2 мл, ДНК контрольна – 50 мкл. Реактив – термостабільну ДНК–полімеразу отримують із спеціального штама Bac. termophilis , сконструйованого методами генної інженерії.
4. Набір для приготування реакційної суміші, до складу якої входять: розчин ДНТФ (дезоксинуклеозидтрифосфати), розчин специфічних праймерів, ПЛР-буфер, барвник. Основним реактивом тут є праймери– специфічні для кожного виду ділянки ДНК; їх отримують хімічним синтезом з відповідною послідовністю для даного виду, що складає 20-30 нуклеотидів. Праймери патентуються і строго зберігаються.
Набори призначені для виявлення in vitro ДНК збудників інфекційних захворювань у біологічних зразках методом ПЛР з праймерами, специфічними до фрагментів геномів цього збудника і можуть бути використані для діагностики і контролю за специфічною терапією певної інфекції, а також бацилоносійства.
Кожний набір розрахований на проведення аналізу 100 клінічних зразків при наявності ДНК збудників 10 зразків позитивного контрольного зразка та 10 зразків негативного (усього 120 визначень).
Зберігання та експлуатація реактивів:
1. Комплекти для виділення ДНК та проведення електрофорезу повинні зберігатися при температурі 4-10˚С.
2. Комплект для проведення ПЛР повинен зберігатися при температурі – 18-25˚С.
Хід роботи:
1. підготовка клінічних зразків (біоптати тканин, крапля крові, сперма, слиз жіночих статевих органів, осад сечі, волосся людини, зішкреби епітеліальних клітин тощо);
2. виділення ДНК зі зразків (ДНК–матриці генів клітин, вірусів і бактерій більш стійкі, ніж РНК, і тому вони придатні для ПЛР після тривалого часу, навіть після тисячелітньої давності їх існування);
3. проведення циклів полімеразної ланцюгової реакції (реакції ампліфікації) – кожний цикл складається з трьох стадій з різними температурними режимами.
На першій стадії при 94˚С проходить розділення ланцюгів ДНК (денатурація ДНК), на другій при 50–65˚С – приєднання (відпалювання) праймерів до гомологічних послідовностей на ДНК–мішені і на третій при температурі 72˚C – синтез нових ланцюгів ДНК, тобто комплементарна добудова ДНК шляхом подовження праймера у напрямку 5’–3’ з участю ДНК–полімерази в присутності іонів магнію.
 | |||||||||||||
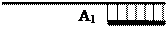 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 |  | ||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 |  | ||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 |  | ||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 |  | ||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 |  | ||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 |  | ||||||||||||
 |
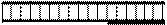
Принципова схема полімеразної ланцюгової реакції. А1, А2 – праймери
Таким чином, у першому циклі ампліфікації синтезуються продукти, які стають матрицями для другого циклу ампліфікації, в результаті якого, власне, і утворюється досліджуваний специфічний фрагмент ДНК – амплікон. Починаючи з третього циклу, амплікони стають матрицями для синтезу нових ланцюгів, тобто у кожному циклі здійснюється подвоєння кількості копій, що дозволяє за 25–40 циклів напрацювати фрагмент ДНК, обмежений парою відібраних праймерів, у кількості, якої достатньо для її детекції за допомогою електрофорезу;
4. розділення продуктів ампліфікації методом горизонтального електрофорезу в агарозному або поліакриламідному гелі; виявляють смуги фрагментів ДНК (ампліконів) за допомогою флуоресцентного барвника (хромофора) – бромистого етидія;
5. перенесення геля на скло трансілюмінатора;
6. аналіз результатів при ввімкнутому трансілюмінаторі, а саме виявлення фрагментів аналізованої ДНК у вигляді оранжево-червоних смуг при УФ–випромінюванні з довжиною хвилі 310 нм; кількість апмпліконів визначають за інтенсивністю їх флуоресценції. Отримані результати можна документувати фотографуванням гелів з використанням оранжевого або інтерференційного (594 нм) світлового фільтру.
Клініко-діагностичне та практичне значення. У медицині метод ПЛР застосовується для діагностики інфекцій шляхом ідентифікації патогенних бактерій і вірусів у біологічних рідинах та біоптатах тнанин людини. З метою діагностики кожної інфекції підбираються специфічні системи праймерів для ПЛР. За допомогою ПЛР одну молекулу ідентифікованої ДНК можна виявити в присутності міліонів інших молекул ДНК. При наявності відповідних наборів можна діагностувати декілька збудників захворювання в одній пробі. Чутливість реакції 97–99 %. ПЛР широко використовують у ранній діагностиці ВІЛ–інфекції, бацилоносійства, вірусних гепатитів тощо, а також для моніторинга і оцінки специфічної терапії певної інфекції, резистентності та чутливості до антибіотиків.
Крім того метод ПЛР використовують для виявлення спадкових захворювань (фенілкетонурія, гемофілія та ін.), проведення „молекулярної дактилоскопії” у судовій практиці, встановлення батьківства , встановлення статі дитини на 10-му тижні вагітності, в онкології тощо.
