Классификация ферментов и номенклатура
По системе IUB, предложенной Международным химическим союзом, ферменты классифицируются в соответствии с типом катализируемой химической реакцией и ее механизмом. Согласно международной классификации ферменты делят на шесть классов, в каждом из которых имеются несколько подклассов (табл. 4).
Таблица 4
Основные классы и подклассы ферментов
| Ферменты | Систематическое название | Катализируемые реакции | Основные подклассы, группы |
| Оксидоредуктазы | По форме «донор: акцептор-оксидоредуктаза», (NAD+ оксидоредуктаза для лактатдегидрогенезы) | Окислительно-восстановительные реакции с участием двух субстратов | Аэробные дегидрогеназы или оксидазы, катализирующие перенос Н+ (электронов) на О2 - анаэробные дегидрогенеазы, ускоряющие перенос Н+ (электронов) на промежуточный субстрат, но не на О2, цитохромы, катализирующие перенос электронов, гемсодержащие ферменты (каталаза и пероксидаза), катализирующие реакции с участием переноса ионов Н+ |
| Трансферазы | «донор: транпортируемая группа-трансфераза» (холин-ацетилтрансфераза) | Реакции межмолекулярного переноса различных атомов, радикалов (отличных от атомов водорода), одноуглеродных групп, альдегидных или кетонных остатков, а также ацильных, алькильных, гликозильных групп, и групп, содержащих фосфор и серу | Киназы (фосфатные группы), транаминазы (аминогруппы), ацилтрансферазы (ацильные группы) |
Окончание таблицы 4
| Ферменты | Систематическое название | Катализируемые реакции | Основные подклассы, группы |
| Гидро- лазы | По форме «субстрат-гидролаза» | Расщепление внутримолекулярных связей органических веществ при расщеплении воды (гидролиз эфирных, сложноэфирных, пептидных, гликозильных связей, кислотных ангидридов, связей С-С , Р-N) | Эстеразы (гидролиз эфиров), гликозидазы (гликозидные связи), фосфотазы (фосфоангидридные связи), пептидогидролазы (пептидные связи) |
| Лиазы | По форме «субстрат-лиаза (фумарат-гидротаза)» | Катализируют разрыв связей С-С, С-N и др. Обратимые реакции отщепления различных групп от субстратов негидролитическим путем с образованием двойных связей | Альдегидлиаза (альдолаза), углерод-кислородлиаза (фумараза), дегидротаза (енолаза), декарбоксилаза (карбоксилиаза) |
| Изоме- разы | «Субстрат-цис-транс-изомераза» | Катализируют реакции взаимопревращения оптических и позиционных изомеров | Изомеразы, мутазы, а также рацемазы, и эпимиразы, действующие на амино- и оксикислоты, углеводы и их производные, внутримолекулярные оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз, внутримолекулярные трансферазы, переносящие ацильные, фосфорильные и др. группы |
| Лигазы (синтетазы) | «X:Y лигаза, где X и Y – исходные вещества» (глутаматсинтетаза) | Катализируют синтез органических веществ из двух молекул с использованием энергии распада АТФ (или других нуклеозидтрифосфатов) | Карбоксилазы, синтетазы |
В пределах классов ферменты группируются в подклассы и подподклассы в соответствии с особенностями катализируемых реакций. Разработанная система служит как для классификации, так и для нумерации (индексации) ферментов. В списке ферментов насчитывается более 3500 индивидуальных ферментов. Шифр фермента состоит из четырех разделенных точками чисел: первое число показывает, к какому из шести классов относится фермент, второе и третье числа показывают подкласс и подподкласс соответственно, а четвертое – порядковый номер фермента в его подподклассе. Например, кислая фосфотаза имеет шифр 3.1.3.2.; это означает, что она относится к классу гидролаз (3.1.3.2.), подклассу этих ферментов, действующих на сложноэфирные связи (3.1.3.2.), к подклассу ферментов, гидролизующих моноэфиры фосфорной кислоты (3.1.3.2.), и что порядковый номер ферментов в этом подклассе «2» (3.1.3.2).
Активный центр ферментов
Ферменты, будучи по своей химической природе белками, являются высокомолекулярными соединениями. Молекулярная масcа ферментов колеблется от 10000 до сотен тысяч дальтон. Длинная цепь фермента сворачивается с образованием «кармана» – участка, называемого активным центром фермента. В этом участке молекула вещества (субстрат) взаимодействует с функциональными группами фермента и претерпевает химические превращения. Активный центр – это уникальная комбинация аминокислотных остатков в молекуле фермента, обеспечивающая непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа (рис. 6).
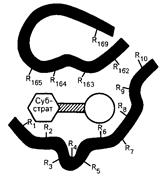
Рис. 12. Активный центр фермента
В активном центре условно различают каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом, и связывающий центр, или контактную якорную площадку, которая обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом.
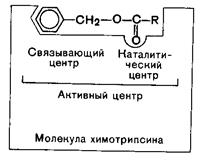
В свою очередь, молекула субстрата также содержит функционально различные участки, одни из которых избирательно взаимодействуют с ферментами, другие подвергаются атаке со стороны фермента.
Формирование активного центра начинается на ранних этапах синтеза белка, а полностью завершается на уровне третичной структуры. Любые воздействия, приводящие к денатурации, т.е. нарушению третичной структуры приводят к искажению или разрушению активного центра.
Помимо активного центра, в молекуле фермента может присутствовать аллостерический центр (центры) (от греч. allos - другой, иной и steros - пространственный, структурный), представляющий собой участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов.
Присоединение эффектора к аллостерическому центру изменяет третичную и частично четвертичную структуру молекулы фермента и, соответственно, конфигурацию активного центра, вызывая снижение или повышение энзиматической активности. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, получили название аллостерических ферментов.
Отличительной особенностью ряда аллостерических ферментов является наличие в молекуле нескольких активных центров и нескольких аллостерических регуляторных центров, пространственно удаленных друг от друга.
