Протеиноиды(перечисли выды белков и что такое протеиноиды)
Протеиноиды(белковоподобные) – фибриллярные, водонерастворимые белки опорных тканей (костей, хрящей, сухожилий, связок). Они представлены коллагеном, эластином, кератином, фиброином.
Коллаген (рождающий клей) –широко распространённый в видах соединительной ткани.
высокое содержание глицина (1/3 всех аминокислот), пролина (1/4 всех аминокислот), лейцина. В составе коллагена присутствуют редкие аминокислоты гидроксипролин и гидроксилизин, но отсутствуют циклические аминокислоты.
Полипептидные цепи коллагена содержит около 1000 аминокислот.
К фибриллообразующим видам коллагена относятся коллаген первого типа (преобладает в коже), коллаген второго типа (преобладает в хрящах) и коллаген третьего типа (преобладает в сосудах).
Вторичная структура коллагена представляет особую «ломаную» альфа-спираль, в витке которой укладывается 3,3 аминокислоты. Шаг спирали равен 0,29 нм.
Кератины -белки волос, ногтей. Они не растворимы в растворах солей, кислот, щелочей. В составе кератинов имеется фракция, которая содержит большое количество серосодеоржащих аминокислот (до 7 – 12%), образующих дисульфидные мостики, придающие высокую прочность этим белкам. Молекулярная масса кератинов очень высока, достигает 2 000 000 д. Кератины могут иметь α– структуру и β- структуру. В α - кератинах три α - спирали объединяются в суперспираль, формирующую протофибриллы. Протофибриллы объединяются в профибриллы, затем в макрофибриллы. Примером β - кератинов является фиброин шёлка.
Эластин – белок эластических волокон, связок, сухожилий. Эластин не растворим в воде, не способен к набуханию. В эластине высока доля глицина, валина, лейцина (до 25 – 30%). Эластичность связана с межцепочечными сшивками при участии аминокислоты лизина.
Сложные белки (протеиды) -перечисли группы и что к ним относится
К сложным белкам (протеидам) относят белки, в которых помимо белковой части содержатся небелковые вещества (простетические группы).
Сложные белки классифицируют по химическому составу их простетической группы.
Выделяют следующие группы сложных белков:
1. хромопротеиды;
2. нуклеопротеиды;
3. липопротеиды;
4. гликопротеиды;
5. фосфопротеиды;
6. металлопротеиды
Хромопротеиды
Хромопротеидысодержат в качестве простетической группы окрашенные небелковые соединения. В группе хромопротеидов выделяют гемопротеиды и флавопротеды.
В гемопоротеидах простетической группой является гем – органическое, железосодержащее вещество, придающее белку красный цвет. Гем соединяется с белком глобином за счёт координационных и гидрофобных связей. Примерами гемопротеидов являются белок эритроцитов гемоглобин, белок мышц миоглобин, тканевые белки цитохромы, ферменты каталаза, пероксидаза. Гемопротеиды участвуют в переносе кислорода и в окислительных процессах в тканях.
В флавопротеидах содержится простетическая группа жёлтого цвета. В качестве простетической группы могут быть представлены нуклеотиды ФАД, ФМН. К флавопротеидам относится фермент сукцинатдегидрогеназа. Некоторые флавопротеиды содержат в своём составе металлы – металлофлавопротеиды. Флавопротеиды участвуют в окислительных процессах в организме.
Нуклеопротеиды
Нуклеопротеидысостоят из белковой части и нуклеиновых кислот: ДНК или РНК. В ядре локализованы дезоксирибонуклеопротеиды, в цитозоле – рибонуклеопротеиды. Белки в нуклепротеидах ядра представлены в основном гистонами. Белковая и небелковые части нуклеопротеидов связаны ионными и гидрофобными связями. При полном гидролизе нуклеопротеидов образуются аминокислоты, фосфорная кислота, углевод и пуриновые или пиримидиновые азотистые основания. Нуклеопротеиды участвуют в хранении и воспроизведении генетической информации.
Липопротеиды
Липопротеиды в качестве простетической группы содержат различные липиды (триацилглицерины, фосфолипиды, холестерин и др.). Между белком и липидом формируются гидрофобные и ионные связи. Липопротеиды принято делить на структурные, входящие в состав клеточных мембран, и транспортные, осуществляющие перенос липидов кровью. Транспортные липопротеиды представляют собой сферические частицы, внутри которых находятся гидрофобные жиры, а на поверхности – фосфолипиды и гидрофильные белки. Примером липопротеида может служить фактор свёртывания крови – тромбопластин.
Фосфопротеиды
Фосфопротеидысодержат остатки фосфорной кислоты, соединённые с радикалами остатков серина, реже треонина белковой части сложноэфирными связями. Присоединение фосфорной кислоты к белку может носить обратимый характер и сопровождаться формированием или разрывом ионных связей фосфорной кислоты и заряженных групп белка, что меняет структуру и биологическую активность фосфопротеида. К фосфопротеидам относятся структурные белки костной ткани, казеиноген молока, ововителлин белка куриного яйца, некоторые ферменты (фосфорилаза, гликогенсинтетаза, ТАГ-липаза).
Гликопротеиды
Гликопротеиды содержат, как правило,прочно присоединенные гликозидными связями остатки углеводов (моносахаридов, олигосахаридов). Гликопротеиды обычно имеют мозаичную структуру, в которой чередуются углеводные и белковые фрагменты.
Углеводная часть придаёт специфичность гликопротеидам и определяет их устойчивость к тканевым ферментам. Гликопротеиды широко представлены в организме человека. Они содержатся как в тканях, так и в биологических жидкостях. Муцин слюны содержит в своём составе до 15% маннозы и галактозы. Гликопротеидами являются некоторые гормоны, например, гонадотропины гипофиза. Некоторые транспортные белки крови относятся к гликопротеидам (трансферрин). Гликопротеидом является фактор свёртывания крови фибриноген, Все виды иммуноглобулинов содержат углеводные фрагменты. Углеводы придают специфичность тканевым рецепторам. Адгезивные белки (фибронектин, ламинин), будучи гликопротеидами, обеспечивают взаимодействие клеток, волокон, гликозаминогликанов соединительной ткани.
Металлопротеиды
Металлопротеиды– сложные белки, в состав которых входят металлы. Например, гемосидерин и ферритин содержат железо, фермент алкогольдегидрогеназа содержит цинк.
В последнее время предложена классификация белков на семейства- группы близких по структуре и функциям белков, имеющие гомологичные последовательности аминокислот. Например, выделяют семействосериновых протеаз, содержащих в активном центре аминокислоту серин и участвующих в расщеплении различных белков. В это семейство входят трипсин, химотрипсин, эластаза, многие ферменты свёртывания крови (тромбин), антисвёртывающей системы (фибринолизин). Семейство иммуноглобулинов включает все виды основных и минорных иммуноглобулинов. Иммуноглобулины имеют вилкообразную структуру, состоящую из двух тяжелых (Н) цепей и двух лёгких цепей (L). Иммуноглобулины, в свою очередь, входят в состав суперсемейства, включающего иммуноглобулины, рецепторы к Т-антигенам, белки гистиосовместимости.
2.Пентозофосфатный путь превращения углеводов: последовательность реакций, распространение, значение, регуляция. Особенности пентозного пути у детей.
Пентозофосфатный путь - альтернативный аэробный способ окисления глюкозы, в котором из глюкозы образуются пентозофосфаты. Данный путь иногда называется апотомическим (верхушечным) окислением. В нём выделяют 2 этапа: окислительный (необратимый) этап и неокислительный (обратимый) этап.
Окислительная часть заключается в окислении глюкозы с последующим выделением
СО2 и переходом глюкозы в пентозы. В окислительных реакциях генерируется НАДФН2.
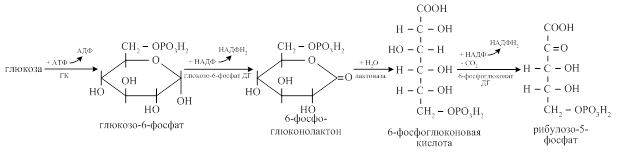
Неокислительная часть заключается в обратимых ферментативных реакциях переноса фрагмента одного углевода на молекулу другого с образованием из пентоз глюкозо-6-фосфата. При этом в каждой неокислительной реакции общее число углеродных атомов в новых веществах равно числу углеродных атомов в исходных веществах.
Одна молекула рибулозо-5-фосфат переходит в ксилулозо-5-фосфат при участии изомеразы, вторая - в рибозо-5-фосфат при участии эпимеразы.
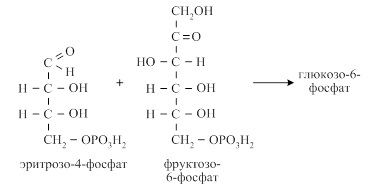
Затем двухуглеродный фрагмент под действием транскетолазы переносится с ксилулозо-5-фосфата на рибозо-5-фосфат с образованием седогептулозо-7-фосфата и 3-фосфоглицеринового альдегида. С седогептулозо-7-фосфата трёхуглеродный фрагмент под действием трансальдолазы переносится на 3-фосфоглицериновый альдегид с образованием эритрозо-4-фосфата и фруктозо-6-фосфата. Фруктозо-6-фосфат переходит в глюкозо-6-фосфат и повторно включается в пентозофосфатный цикл.
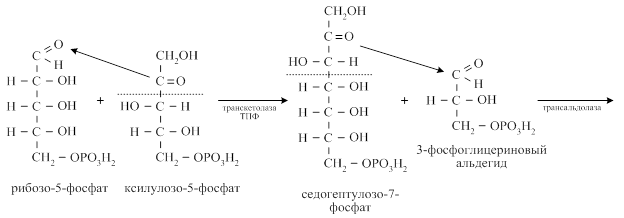
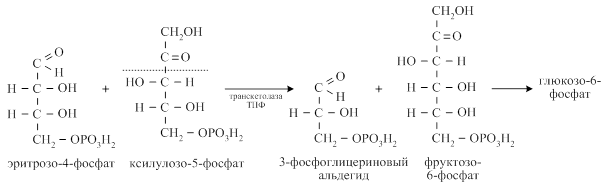
Образовавшийся в трансальдолазной реакции эритрозо-4- фосфат взаимодействует ещё с одной молекулой ксилулозо-5-фосфата при участии транскетолазы с образованием фруктозо-6-фосфата и 3-фосфоглицеринового альдегида.
Итоговое уравнение пентозофосфатного пути:
6 молекул глюкозы + 12 НАДФ → 5 молекул глюкозы + 6 СО2 + 12 НАДФН2
Биологическая роль первого этапа пентозофосфатного пути у взрослого человека состоит в выполнении двух важных функций:
· он является поставщиком пентоз, которые необходимы для синтеза нуклеотидов, как структурных компонентов нуклеиновых кислот, коферментов, макроэргов.
· служит источником НАДФН2, который, в свою очередь, используется:
1. в восстановительных синтезах стероидных гормонов, жирных кислот.
2. активно участвует в обезвреживании токсичных веществ в печени.
3. в эритроцитах НАДФН2 восстанавливает трипептид глютатион, обеспечивая тем самым резистентность эритроцитов.
Одна из функций второго этапа пентозофосфатного цикла состоит в том, что он даёт возможность утилизировать излишки пентоз путём их биотрансформации в гексозы.
Пентозофосфатный путь, выполняя в основном пластическую функцию, активен в таких тканях как лактирующая молочная железа, жировая ткань, надпочечники.
3. Эндокринная функция эпифиза, тимуса и половых желез. Гормональный статус системы мать- плацента- плод.
Тимус является органом лимфопоэза, тимопоэза и органом выработки гормонов, определяющих иммунные процессы в организме. Эта железа активна в детском возрастеОсновные гормоны вилочковой железы имеют пептидную природу. К ним относятся:
· α,β – тимозины – определяют пролиферацию Т-лимфоцитов;
· I, II-тимопоэтины – усиливают созревание Т-лимфоцитов, блокируют нервно - мышечную возбудимость;
· тимусный гуморальный фактор – способствует дифференцировке Т-лимфоцитов на киллеры, хелперы, супрессоры;
· лимфоцитостимулирующий гормон – усиливает образование антител;
· тимусный гомеостатический гормон – является синергистом соматотропина и антагонистом кортикотропина и гонадотропина, и поэтому тормозит преждевременное половое созревание.
При гипофункции тимуса развиваются иммунодефицитные состояния. При гиперфункции возникают аутоиммунные заболевания.
Гормоны эпифиза
Эпифиз продуцирует гормоны мелатонин, адреногломерулотропин, эпиталамин.
Мелатонин является производным триптофана. Мелатонин регулирует синтез тканевых пигментов (меланинов), оказывает осветляющий эффект в ночное время суток и является антагонистом меланотропина гипофиза. Мелатонин влияет на дифференцировку клеток, оказывает противоопухолевое действие, стимулирует иммунные процессы, препятствует преждевременному половому созреванию. Вместе с эпиталамином (пептид) определяет биологические ритмы организма: выработку гонадотропных гормонов, суточные ритмы, сезонные ритмы.
Адреногломерулотропин (производное триптофана) активирует в надпочечниках выработку минералокортикоидов и, таким образом, регулирует водно-минеральный обмен.
Половые гормоны
Выделяют женские (синтезируются в яичниках) и мужские (в семенниках). Соответственно: эстрогены и андрогены.
1. Мужские половые гормоны (андрогены) - синтезируются из холестерола. .Наиболее важным из андрогенов является тестостерон. Тестостерон разрушается в печени, а его метаболиты экскретируются с мочой.Тестостерон участвует в половой дифференцировке гонады и обеспечивает развитие первичных (рост полового члена и яичек) и вторичных (мужской тип оволосения, низкий голос, характерное строение тела, особенности психики и поведения) половых признаков, появление половых рефлексов.Продукция тестостерона регулируется лютеинизирующим гормоном аденогипофиза по механизму обратной связи. Повышенное содержание в крови тестостерона тормозит выработку лютропина, сниженное - ускоряет.
2. Женские половые гормоны (эстрогены) – их секреция регулируется гормонами гипофиза и гипоталамуса, а также по принципу обратной связи, эстрадиолом. Транспортируются кровью в связи с белками, выводятся в виде метаболитов (в результате превращений в печени) с мочой. В фолликулах яичников осуществляется синтез эстрогенов, желтое тело яичника продуцирует прогестерон. Уровень секреции гормонов резко меняется в различные фазы менструального цикла. Функции эстрогенов – стимуляция кровотока в матке, пролиферация эндометрия, обеспечивает овуляцию. . Все половые гормоны являются производными холестерина. .
Билет 10
1.Роль ферментов в метаболизме. Современные данные о химической природе ферментов. Изоферменты. Кофакторы ферментов. Общие сведения о классификации и номенклатуре ферментов. Изменчивость изоферментов в онтогенезе.
. Ферменты - биологические катализаторы.
Все ферменты являются белками, как правило, глобулярными. Они могут относиться как к простым, так и к сложным белкам. Белковая часть фермента может состоять из одной полипептидной цепи и относиться к мономерным белкам (например, пепсин). Ряд ферментов являются олигомерными белками, включают в свой состав несколько протомеров или субъединиц. Протомеры, объединяясь в олигомерную структуру, соединяются самопроизвольно непрочными нековалентными связями. В процессе объединения (кооперации) происходят структурные изменения отдельных протомеров, в результате чего активность фермента заметно возрастает. Отделение (диссоциация) протомеров и их объединение в олигомерный белок является механизмом регуляции активности ферментов.
Субъединицы (протомеры) в олигомерах могут быть или одинаковыми, или отличающимися по первичной - третичной структуре (конформации). В случае соединения различных протомеров в олигомерную структуру фермента возникают множественные формы одного и того же фермента – изоферменты.
Изоферменты катализируют одну и ту же реакцию, но отличаются по набору субъединиц, физико-химическим свойствам, электрофоретической подвижности, по сродству к субстратам, активаторам, ингибиторам. Например, лактатдегидрогеназа (ЛДГ) – фермент, окисляющий молочную кислоту в пировиноградную кислоту, является тетрамером. Он состоит из четырёх протомеров двух типов. Один вид протомеров обозначается Н (выделен из сердечной мышцы), второй протомер обозначается М (выделен из скелетной мускулатуры). Возможно 5 сочетаний этих протомеров в составе ЛДГ: Н4, Н3М, Н2М2, Н1М3, М4 соответственно ЛДГ1, ЛДГ2,ЛДГ3,ЛДГ4, ЛДГ5.
Биологическая роль изоферментов.(не читать,это дополнительно)
· Изоферменты обеспечивают протекание химических реакций в соответствии с условиями в разных органах. Так, изофермент ЛДГ1 – обладает высоким сродством к кислороду, поэтому он активен в тканях с высокой скоростью окислительных реакций (эритроциты, миокард). Изофермент ЛДГ5 активен в присутствии высокой концентрации лактата, наиболее характерен для ткани печени.
· Выраженная органоспецифичность изоферментов используется для диагностики заболеваний различных органов.
· Изоферменты изменяют свою активность с возрастом. Так, у плода при недостатке кислорода преобладает ЛДГ3, а с увеличением возраста и увеличением поступления кислорода возрастает доля ЛДГ2.
Если фермент является сложным белком, то он состоит из белковой и небелковой части. Белковая часть - апофермент. Он имеет своеобразную структуру и определяет специфичность ферментов.
Небелковая часть фермента называется кофактором (коферментом). Кофактором чаще всего являются ионы металлов,Коферментами являются, в частности, нуклеотиды НАД, ФАД. Кофермент– низкомолекулярная, термостабильная часть фермента. Его роль заключается в том, что он определяет пространственную укладку (конформацию) апофермента, и определяет его активность. Некоторые кофакторы могут переносить электроны, функциональные группы, участвовать в образовании дополнительных связей между ферментом и субстратом.
Номенклатура ферментов
Ферменты имеют несколько типов названий.
· Тривиальные названия (трипсин, пепсин).
· Рабочая номенклатура. В данном названии фермента присутствует окончание – аза, которое прибавляется:
o к названию субстрата (сахараза, амилаза);
o к виду связи, на которую действует фермент (пептидаза, гликозидаза);
o к типу реакции, процесса (синтетаза, гидролаза).
3) У каждого фермента есть классификационное название, в котором отражается тип реакции, вид субстрата и кофермента. Например: ЛДГ – L лактат-НАД+ - оксидоредуктаза.
Классификация ферментов
Согласно классификации каждый фермент расположен в определённом классе, подклассе, подподклассе и имеет порядковый номер. В связи с этим каждый фермент имеет цифровой шифр, в котором первая цифра обозначает класс, вторая – подкласс, третья – подподкласс, четвертая – порядковый номер (ЛДГ: 1.1.1.27.). Все ферменты классифицируются на 6 классов:
1. Оксидоредуктазы.----1. Дегидрогиназы 2. Оксигеназы 3. Пероксидазы
2. Трансферазы.------аминотрансферазы, метилтрансферазы, сульфотрансферазы, ацилтрансферазы (переносят остатки жирных кислот), фосфотрансферазы (переносят остатки фосфорной кислоты).
3. Гидролазы. пептидазы расщепляют пептидные связи (пепсин), гликозидазы - гликозидные связи (амилаза), эстеразы – сложноэфирные связи (липаза).
4. Лиазы -----Альдолазы катализируют разрыв связи между двумя атомами углерода (например, фруктоза 1,6-ди-фосфатальдолаза «разрезает» фруктозу на две фосфотриозы). К лиазам относят ферменты декарбоксилазы (отщепляют углекислый газ), дегидратазы («вырезают» молекулы воды).
5. Изомеразы.------мутазы (фосфоглюкомутаза переводит глюкозо- 1- фосфат в глюкозо-6-фосфат), эпимеразы (например, переводят рибозу в ксилулозу), таутомеразы
6.Синтетазы (лигазы).Например, глютаминсинтетаза катализирует взаимодействие глютаминовой кислоты с NH3, при участии АТФ с образованием глютамина.
2.Глюконеогенез: последовательность реакций, значение, регуляция. Взаимосвязь гликолиза в мышцах и глюконеогенеза в печени (цикл Кори). Значение глюконеогенеза в метаболизме плода.
Глюконеогенез - это путь синтеза глюкозы в организме из неуглеводных веществ, который способен длительно поддерживать уровень глюкозы при отсутствии углеводов в пищевом рационе. Исходными веществами для него являются молочная кислота, ПВК, аминокислоты, глицерин. Наиболее активно глюконеогенез протекает в печени и почках. Этот процесс внутриклеточно локализован частично в цитозоле, частично в митохондриях. В целом глюконеогенез является процессом обратным гликолизу.
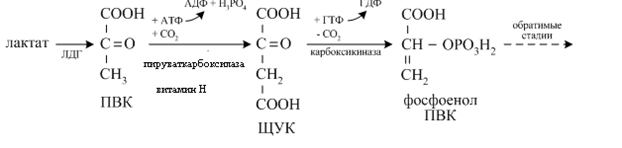
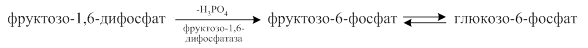
В гликолизе имеются три необратимых стадии, катализируемых ферментами:
· пируваткиназа;
· фосфофруктокиназа;
· гексокиназа.
Поэтому в глюконеогенезе вместо этих ферментов имеются специфические ферменты, которые осуществляют «обход» этих необратимых стадий:
· пируваткарбоксилаза и карбоксикиназа («обходят» пируваткиназу);
· фруктозо-6-фосфатаза («обходит» фосфофруктокиназу);
· глюкозо-6-фосфатаза («обходит» гексокиназу).
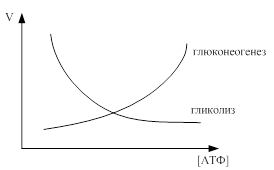
Ключевыми ферментами для глюконеогенеза являются пируваткарбоксилаза и фруктозо-1,6-дифосфатаза. Активатором для них являются АТФ (на синтез одной молекулы глюкозы необходимо 6 молекул АТФ).
Таким образом, высокая концентрация АТФ в клетках активирует глюконеогенез, требующий затраты энергии и в то же время ингибирует гликолиз (на стадии фосфофруктокиназы), ведущий к образованию АТФ. Данное положение иллюстрирует приведенный ниже график.
· При интенсивном поступлении кислорода в аэробных условиях молочная кислота превращается в ПВК и через ацетил КоА включается в цикл Кребса, давая энергию.
· Молочная кислота транспортируется из мышц в печень, где используется на синтез глюкозы – цикл Р. Кори.
Цикл Кори
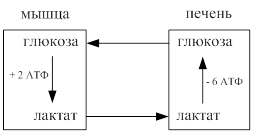
· При больших концентрациях молочной кислоты в тканях для предотвращения закисления (ацидоза) она может выделяться через почки и потовые железы.
3.Гормоны гипофиза. Связь функции гипофиза с гипоталамусом: роль либеринов, статинов, тропных гормонов.
Гормоны гипофиза
Гормонами передней доли гипофиза являются соматотропин, пролактин (простые белки), тиреотропин, фоллиторопин, лютропин (гликопротеиды), кортикотропин, липотропин (пептиды).
Соматотропин – белок, включающий около 200 аминокислот. Он обладает выраженным анаболическим действием, активирует глюконеогенез, синтез нуклеиновых кислот, белков, в частности, коллагена, синтез гликозаминогликанов. Соматотропин вызывает гипергликемический эффект, усиливает липолиз.
Гипофункция у детей ведёт к гипофизарной карликовости (нанизм). Гиперфункция у детей сопровождается гигантизмом, а у взрослых - акромегалиёй.
Пролактин - гормон белковой природы. Его продукция активируется в период лактации. Пролактин стимулирует: маммогенез, лактопоэз, эритропоэз
Фоллитропин – гликопротеид, определяет цикличность созревания фолликулов, выработку эстрогенов у женщин. В мужском организме он стимулирует сперматогенез.
Лютропин – гликопротеид, в женском организме способствует формированию желтого тела и выработке прогестерона, в мужском организме стимулирует сперматогенез и продукцию андрогенов.
Тиреотропин – гликопротеид, стимулирует развитие щитовидной железы, активирует синтез белков, ферментов.
Кортикотропин – пептид, включающий 39 аминокислот, активирует созревание надпочечников и выработку кортикостероидов из холестерина. Гиперфункция - синдром Иценко-Кушинга, проявляется гипергликемией, гипертензией, остеопорозом, перераспределением жиров с накоплением их на лице и груди.
Липотропинвключает в свой состав около100 аминокислот, стимулирует распад жиров, служит источником эндорфинов. Гиперфункция сопровождается гипофизарной кахексией, гипофункция - гипофизарным ожирением.
К гормонам средней доли гипофиза относится меланотропин (меланоцитостимулирующий гормон). Он является пептидом, стимулирует формирование меланоцитов и синтез в них меланинов, которые обладают фотопротекторным действием и являются антиоксидантами.
К гормонам задней доли гипофиза относятся вазопрессин (антидиуретический гормон) и окситоцин. Данные гормоны являются нейросекретами, они синтезируются в гипоталамических ядрах, а затем перемещаются в заднюю долю гипофиза. Оба гормона состоят из девяти аминокислот.
Вазопрессин регулирует водный обмен, усиливает в почках синтез белка аквапорина и реабсорбцию воды в почечных канальцах. Вазопрессин суживает сосуды и повышает артериальное давление. Недостаток гормона приводит к заболеванию несахарный диабет, проявляющийся резким увеличением диуреза.
Окситоцин стимулирует сокращение мускулатуры матки, сокращает гладкую мускулатуру молочных желез, усиливает отделения молока. Окситоцин активирует синтез липидов.
Гипоталамо-гипофизарная система — объединение структур гипофиза игипоталамуса, выполняющее функции как нервной системы, так и эндокринной. Работа гипофиза управляется гипоталамусом с помощью особых нейросекреторныхклеток. Эти клетки выделяют специальные гормоны — рилизинг-гормоны.
Под действием импульсов ЦНС в гипоталамусе синтезируется либерины (кортиколиберин, тиреолиберин, соматолиберин, пролактолиберин, гонадолиберин), которые активируют функцию передней доли гипофиза, и статины, тормозящие функцию передней доли гипофиза (соматостатин, пролактостатин, меланостатин). Либерины и статины регулируют выработку тропных гормонов передней доли гипофиза. Тропины передней доли гипофиза, в свою очередь, активируют функцию периферических эндокринных желез, которые вырабатывают соответствующие гормоны. Высокая концентрация гормонов тормозит либо выработку тропных гормонов, либо выработку либеринов (отрицательная обратная связь).
Билет 11
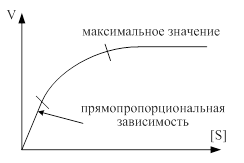
1.Зависимость скорости ферментативных реакций от концентрации фермента и субстрата. Уравнение Михаэлиса-Ментен. Константа Михаэлиса, её графическое определ Зависимость скорости реакции от концентрации фермента и концентрации субстрата (кинетика ферментативных реакций) представлена соответственно на графиках.
График 1 График 2
В ферментативной реакции выделяют скорости трёх составляющих этапов:
1. образование фермент-субстратного комплекса FS;
2. обратный распад фермент – субстратного комплекса;
3. распад фермент-субстратного комплекса с образованием продуктов реакции.
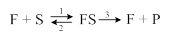
Скорость каждой из этих реакций подчиняется закону действующих масс:
V1 = К1 [F] ·[S]
V2 = K2 [FS]
V3 = K3 [FS]
В момент равновесия скорость реакции образования FS равна сумме скоростей его распада: V1=V2+V3. Из трёх этапов ферментативной реакции наиболее важным и медленным является третий, так как он связан с образованием продуктов реакции. По приведенной выше формуле найти скорость V3 невозможно, так как фермент- субстратный комплекс очень неустойчив и измерение его концентрации затруднено. В связи с этим, Л. Михаэлис, М.Ментен ввели константу Михаэлиса - Кm и преобразовали уравнение для измерения V3 в новое уравнение, в котором присутствуют реально измеримые величины. Ниже представлены два варианта данного уравнения
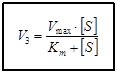
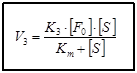
[F0] – исходная концентрация фермента;
Кm – константа Михаэлиса.
Физический смысл Кm: Кm = (К2+К3) /К1, т.е. она показывает соотношение констант скоростей распада фермент-субстратного комплекса и константы скорости его образования.
Уравнение Михаэлиса-Ментен является универсальным. Оно иллюстрирует зависимость скорости реакции от [F0] от [S].
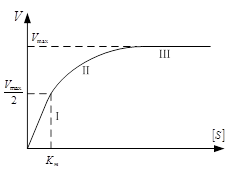
1. Зависимость скорости реакции от концентрации субстрата. Эта зависимость выявляется при малых концентрациях субстрата [S]<Km. В этом случае концентрацией субстрата в уравнении можно пренебречь и уравнение приобретает вид: . В данном уравнении K3, [F0], Km – константы и могут быть заменены новой константой К*. Таким образом, при малой концентрации субстрата скорость реакции прямо пропорциональна этой концентрации V3 = K* · [S]. Эта зависимость соответствует первому участку графика 2.
2. Зависимость скорости от концентрации фермента проявляется при высокой концентрации субстрата. S > Km. В этом случае можно пренебречь Km и уравнение преобразуется в следующее:. Таким образом, при высокой концентрации субстрата скорость реакции определяется концентрацией фермента и достигает максимального значения V3 = K3[F0]=Vmax. (третий участок графика 2).
3. Уравнение позволяет определить численное значение Km при условии . В этом случае оно приобретает вид: , откуда следует, что Km=[S]
Таким образом, Кm численно равна концентрации субстрата при скорости реакции, равной половине максимальной. Кm является очень важной характеристикой фермента, она измеряется в молях (10-2 – 10-6 моль) и характеризуют специфичность фермента: чем ниже Km, тем выше специфичность фермента.
Графическое определение константы Михаэлиса возможно на графике зависимости скорости ферментативной реакции от концентрации фермента (слева).
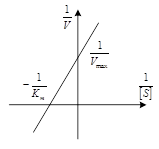
Удобнее использовать график, представляющий прямую линию. Такой график предложен Лайнуивером – Берком (график двойных обратных величин), который соответствует обратному уравнению Михаэлиса – Ментен (справа)
.
Регуляция концентрации глюкозы в крови. Пути поступления и пути расходования глюкозы крови. Влияние на эти процессы инсулина, адреналина, кортизола и глюкагона. Гипо- и гипергликемия, причины их возникновения. Определение толерантности к глюкозе при диагностике сахарного диабета. Гиперкортицизм.
1. Авторегуляция на клеточном уровне осуществляется путём либо аллостерических механизмов изменения активности ферментов либо путём фосфорилирования - дефосфорилирования. Например, АТФ и АДФ являются аллострическими регуляторами ключевых ферментов гликолиза и глюконеогенеза: высокая концентрация АТФ активирует ферменты глюконеогенеза, а высокая концентрация АДФ активируют ключевые ферменты гликолиза. Высокая концентрация сукцинил -КоА является аллостерическим активатором фермента пируваткарбоксилазы (активен ЦТК, высокая концентрация янтарной кислоты, поэтому активируется глюконеогенез, требующий затрат АТФ из ЦТК).
2. Нервная регуляция, подтверждением которой является «сахарный укол» - раздражение дна четвертого желудочка приводит к повышению уровня глюкозы в крови.
3. Эндокринная регуляция при участии гормонов гипофиза, щитовидной железы, поджелудочной железы и надпочечников.
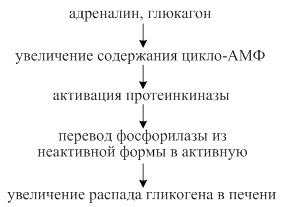
Механизм действия гормонов в конечном итоге сводится к изменению активности ферментов углеводного обмена либо аллострическим путём, либо путём фосфорилирования - дефосфорилрования ферментов. Свой эффект некоторые гормоны реализуют с участием посредников. Одним из посредников является цикло-АМФ.
Инсулин- гормон белковой природы, вырабатывается β - клетками островков поджелудочной железы в ответ на повышение уровня глюкозы в крови («гормон сытости»). В целом оказывает гипогликемическое действие (снижает содержание глюкозы в крови). Механизм действия инсулина сложен и многообразен. Инсулин увеличивает проницаемость тканей для глюкозы, активирует синтез активного изомера фермента гексокиназы. В результате усиливается использование глюкозы в тканях для синтеза гликогена, синтеза жиров, синтеза некоторых аминокислот. Одновременно тормозится процесс распада гликогена, глюконеогенез.
Глюкагон- гормон пептидной природы, образуется в α - клетках поджелудочной железы, его называют «гормоном голода». Оказывает гипергликемическое действие. Этот эффект реализуется в основном за счёт усиления распада гликогена в печени (фосфоролиз). В меньшей степени глюкагон активирует глюконеогенез. Рецепторы для глюкагона имеются в печени и жировой ткани.
Адреналин - гормон мозгового слоя надпочечников, является производным аминокислоты тирозина. Рецепторы к адреналину содержатся в печени, жировой ткани и в мышцах. Этот гормон называют «гормоном тревоги». Он обладает гипергликемическим эффектом путём активации распада гликогена в печени.
Тироксин, трийодтиронин - производные тирозина. В физиологических концентрациях тиреоидные гормоны увеличивают потребление кислорода, активирует синтез многочисленных ферментов углеводного обмена и в целом оказывают гипергликемическое действие.
Кортизон, кортизол, дезоксикортикостерон (глюкокортикоиды) – производные холестерина. Вырабатываются в корковом слое надпочечников. Рецепторы к ним имеются в мышечной ткани, соединительной ткани, печени. Эти гормоны обладают гипергликемическим действием за счёт усиления распада аминокислот в периферических тканях и усиления синтеза глюкозы в печени (активируют глюконеогенез).
Кортикотропин, соматотропин – гормоны задней долигипофиза, повышают уровень глюкозы в крови опосредованно.
3.Переваривание белков. Протеиназы желудочно-кишечного тракта и их проферменты. Субстратная специфичность протеиназ. Эндо- и экзопептидазы. Всасывание аминокислот. Возрастная характеристика процессов перевааривания и всасывания белков.
Переваривание белков происходит в желудке и в тонком кишечнике. Оно сводится к ферментативному гидролитическому расщеплению белков пищи до аминокислот. Переваривание белков в желудочно-кишечном тракте имеет ряд особенностей:
· протеолитические ферменты выделяются в неактивном состоянии (защитный механизм от переваривания тканевых белков);
· их активирование происходит в просвете желудочно-кишечного тракта путём частичного протеолиза;
· протеазы желудочно–кишечного тракта отличаются субстратной специфичностью, могут относиться или к эндопептидам, или экзопептидазам.
В желудке основным ферментом, расщепляющим белки, является пепсин. Он выделяется в неактивном состоянии в виде профермента пепсиногена. При участии HCl происходит частичный протеолиз пепсиногена и превращение его в активную форму пепсин. При частичном протеолизе уменьшается молекулярная масса, изменяется структура фермента, обнажается его активный центр.
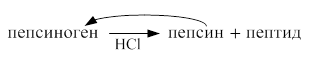
Пепсин относится к эндопептидазам, разрывает в белках внутренние пептидные связи, образованные с участием остатков тирозина и фенилаланина..
Роль HCl в переваривании белков:
· участвует в активации пепсиногена;
· обеспечивает оптимум рН для пепсина (рН = 1-2);
· вызывает частичную денатурацию белка, способствует их набуханию;
· является бактерицидным барьером.
Слизистая желудка имеет целый ряд защитных механизмов от агрессивного действия пепсина и соляной кислоты. К ним относятся:
а) выработка слизи (основной её компонент протеогликаны);
б) выделение пепсина в неактивном состоянии;
Всасывание аминокислот представляет собой активный Na-зависимый процесс, требующий затрат энергии АТФ. Перенос отдельных аминокислот осуществляется специальными переносчиками с участием трипептида глютатиона.
Дальнейшее переваривание белков осуществляется в тонком кишечнике под действием ферментов поджелудочной железы и собственных ферментов слизистой оболочки кишечника. К ферментам поджелудочной железы относятся трипсин, химотрипсин, эластаза, карбоксипептидазы. Трипсин выделяется поджелудочной железой в неактивном состоянии в виде трипсиногена, который активируется ферментом энтеропептидазой (энтерокиназой). Химотрипсин вырабатывается в неактивном состоянии в виде химотрипсиногена, активируется частичным протеолизом трипсином. Химотрипсин относится к эндопептидазам, содержит в активном центре гидрофобные аминокислоты, расщепляет в белках связи, образованные СООН – группами ароматических аминокислот (фенилаланин, тирозин). Эластаза образуется из проэластазы под действием трипсина путём частичного протеолиза. В активном центре эластазы преобладают аминокислоты с разветвлённым радикалом, поэтому она расщепляет в белках внутренние пептидные связи, образованные глицином, не содержащим радикала. Карбоксипептидазы относятся к экзопептидазам, отщепляют от белков концевые аминокислоты.
К ферментам кишечника относятся аминопептидазы и дипептидазы. Аминопептидазы – экзопептидазы, отщепляют N-концевые аминокислоты. К аминопептидазам относится, в частности, лейцинаминопептидаза (ЛАП). Дипептидазы кишечника расщепляют дипептиды. В тонком кишечнике происходит полное гидролитическое расщепление пищевых белков до аминокислот, которые не обладают видовой специфичностью. Образовавшиеся аминокислоты подвергаются всасыванию.
Билет 12
1. Активаторы ферментов: механизм действия различных активаторов. Ингибиторы ферментов: обратимые и необратимые, конкурентные и неконкурентные. Применение активаторов и ингибиторов как лекарственных средств.
Активаторы – вещества, повышающие скорость ферментативных реакций. Различают специфические активаторы, повышающие активность одного фермента (НСl - активатор пепсиногена) и неспецифические активаторы, увеличивающие активность целого ряда ферментов (ионы Mg – активаторы гексокиназы, К, Na –АТФ-азы и ряда других ферментов). В качестве активаторов могут служить ионы металлов, метаболиты, нуклеотиды.
Механизм действия активаторов может быть различным.
1.Достраивание активатором активного центра фермента, в результате чего облегчается взаимодействие фермента с субстратом. Таким механизмом обладают в основном ионы металлов.
2.Аллостерический активатор взаимодействует с аллостерическим участком (субъединицей) фермента, через его изменения опосредованно изменяет структуру активного центра и увеличивает активность фермента. Аллостерическим эффектом обладают метаболиты ферментативных реакций, АТФ.
3.Аллостерический механизм может сочетаться с изменением олигомерности фермента. Под действием активатора происходит объединение нескольких субъединиц в олигомерную форму, что резко увеличивает активность фермента. Например, изоцитрат является активатором олигомерного фермента ацетил-КоА карбоксилазы.
4.Фосфолирирование - дефосфолирирование ферментов относится к обратимой модификации ферментов. Присоединение Н3РО4 чаще всего резко увеличивает активность фермента. Например, два неактивных димера фермента фосфорилазы соединяются с четырьмя молекулами АТФ и образуют активную тетрамерную фосфорилированную форму фермента. Фосфолирирование ферментов может сочетаться с изменением их олигомерности. В некоторых случаях фосфорилирование фермента, наоборот, снижает его активность (например, фосфорилирование фермента гликогенсинтетазы)
5.Частичный протеолиз (необратимая модификация). При данном механизме от неактивной формы фермента (профермента) отщепляется фрагмент молекулы, блокирующий активный центр фермента. Например, неактивный пепсиноген под действием HCL переходит в активный пепсин.
