Стационарная кинетика ферментативных реакций
Кинетика ферментативных реакций – раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической природы реагирующих веществ, а также факторов окружающей среды. Чтобы понять и правильно оценить результаты определения ферментативной активности, нужно совершенно отчётливо представлять себе, от каких факторов зависит скорость реакции, какие условия оказывают влияние на неё. Таких условий много. Прежде всего, это соотношение концентраций самих реагирующих веществ: фермента и субстрата. Также важны условия, в которых протекает реакция: температура, кислотность, присутствие регуляторных молекул (активаторов и ингибиторов), солей и других примесей, способных как ускорить, так и замедлить ферментативный процесс, и т.д.
Концентрация субстрата
Одним из наиболее существенных факторов, определяющих скорость ферментативной реакции, является концентрация субстрата (или субстратов) и продукта (продуктов). В случае постоянной концентрации фермента скорость реакции постепенно увеличивается, достигая определенного максимума (рис. 14.15), при котором дальнейшее увеличение количества субстрата практически не оказывает влияния на скорость ферментативной реакции. В таких случаях принято считать, что субстрат находится в избытке, а фермент полностью насыщен, т. е. все молекулы фермента связаны с субстратом. Фактором, ограничивающим скорость реакции, при этом становится концентрация фермента.
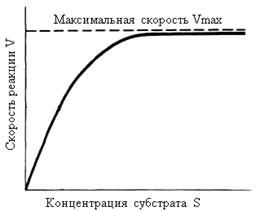
Рис. 14.15 График зависимости скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента
Концентрация фермента
Скорость любой ферментативной реакции непосредственно зависит от концентрации фермента (рис.14.16). Линейная зависимость между этими величинами, когда скорость реакции прямо пропорциональна количеству присутствующего фермента, справедлива только в определенных условиях, например в начальный период ферментативной реакции, т. к. в этот период практически не происходит обратной реакции, а концентрация продукта оказывается недостаточной для обратимости реакции. Именно в этом случае скорость реакции (точнее, начальная скорость реакции v) будет пропорциональна концентрации фермента.
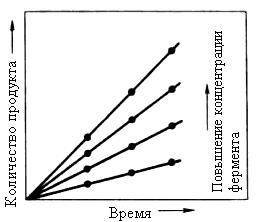
Рис. 14.16 Зависимость скорости реакции от концентрации фермента в присутствии избытка субстрата
Температура
Скорость химических реакций зависит и от температуры, поэтому катализируемые ферментами реакции также чувствительны к её изменениям. Установлено, что скорость большинства биохимических реакций повышается в 2 раза при повышении температуры на 10°С и, наоборот, снижается в 2 раза при понижении температуры на 10°С. Этот показатель получил название температурного коэффициента. Однако вследствие белковой природы фермента тепловая денатурация при повышении температуры будет снижать эффективную концентрацию фермента с соответствующим снижением скорости реакции. Так, при температуре, не превышающей 45-50°С, скорость реакции увеличивается согласно теории химической кинетики. При температуре выше 50°С на скорость реакции большое влияние начинает оказывать тепловая денатурация белка-фермента, приводящая к полному прекращению ферментативного процесса (рис. 14.17).
Таким образом, термолабильность, или чувствительность к повышению температуры, является одним из характерных свойств ферментов, резко отличающих их от неорганических катализаторов. В присутствии последних скорость реакции возрастает экспоненциально при повышении температуры (кривая «а» на рис. 14.17). При температуре 100°С почти все ферменты утрачивают свою активность: Исключение составляет, очевидно, только один фермент мышечной ткани – миокиназа, которая выдерживает нагревание до 100°С.
Оптимальной для действия большинства ферментов теплокровных животных является температура 40°С; в этих условиях скорость реакции оказывается максимальной вследствие увеличения кинетической энергии реагирующих молекул. При низких температурах (0°С и ниже) ферменты, как правило, не разрушаются, хотя активность их падает почти до нуля.
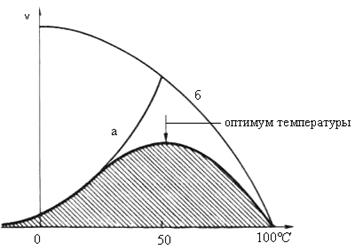
Рис. 14.17Зависимость скорости катализируемой ферментом реакции от температуры: а – повышение скорости реакции как функция температуры; б - снижение скорости реакции как функция денатурации белка-фермента
Во всех случаях имеет значение время воздействия соответствующей температуры. Следует отметить, что на термолабильность ферментов определенное влияние оказывают концентрация субстрата, величина рН среды и другие факторы.
Величина рН среды
Ферменты обычно наиболее активны в пределах узкой зоны концентрации водородных ионов, соответствующей для животных тканей в основном выработанным в процессе эволюции физиологическим значениям рН среды 6,0–8,0. При графическом изображении на кривой колоколообразной формы имеется определенная точка, в которой фермент проявляет максимальную активность; эту точку называют оптимумом рН среды для действия данного фермента (рис. 14.18).
При определении зависимости активности фермента от концентрации водородных ионов реакцию проводят при разных значениях рН среды, обычно при оптимальной температуре и достаточно высокой (насыщающей) концентрации субстрата. В табл. 14.3 приводятся оптимальные значения рН среды для ряда ферментов.
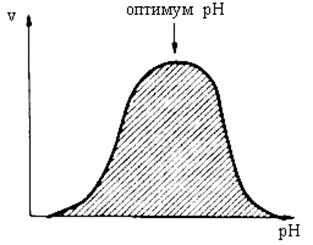
Рис. 14.18Зависимость скорости реакции от значения рН
Из данных табл. 14.3 видно, что рН-оптимум действия ферментов лежит в пределах физиологических значений. Исключение составляет пепсин, рН-оптимум которого 2,0 (при рН 6,0 он неактивен и нестабилен). Объясняется это, во-первых, структурной организацией молекулы фермента и, во-вторых, тем, что пепсин является компонентом желудочного сока, содержащего свободную соляную кислоту, которая создает оптимальную кислую среду для действия этого фермента. С другой стороны, рН-оптимум аргиназы лежит в сильнощелочной зоне (около 10,0); такой среды нет в клетках печени, следовательно, in vivo аргиназа функционирует, по-видимому, не в своей оптимальной зоне рН среды.
Таблица 14.3
Оптимальные значения рН для некоторых ферментов
| Фермент | рН | Фермент | рН |
| Пепсин | 1,5-2,5 | Каталаза | 6,8-7,0 |
| Катепсин В | 4,5-5,0 | Уреаза | 7,0-7,2 |
| Амилаза из солода | 4,9-5,2 | Липаза панкреатич. | 7,0-8,5 |
| Сахараза кишечная | 5,8-6,2 | Трипсин | 7,5-8,5 |
| Амилаза слюны | 6,8-7,0 | Аргиназа | 9,5-10,0 |
Согласно современным представлениям влияние изменений рН среды на молекулу фермента заключается в воздействии на состояние и степень ионизации кислотных и основных групп (в частности, СООН-группы дикар-боновых аминокислот, SH-группы цистеина, имидазольного азота гисти-дина, NH2-группы лизина и др.). При резких сдвигах от оптимума рН среды ферменты могут подвергаться конформационным изменениям, приводящим к потере активности вследствие денатурации или изменения заряда молекулы фермента. При разных значениях рН среды активный центр может находиться в частично ионизированной или неионизированной форме, что сказывается на третичной структуре белка и соответственно на формировании активного фермент-субстратного комплекса. Кроме того, имеет значение состояние ионизации субстратов и кофакторов.
