CaHPO4®Ca4H(PO4)3®Ca5(PO4)3OH
Количественные характеристики буферных систем: зона буферного действия и буферная емкость. Факторы влияющие на буферную емкость. Распределение буферных систем в цельной крови и сыворотке по буферной емкости




Зона буферного действия -буферные системы , проявляющие свои буферные свойства в диапозоне значений ph приблизительно 2 единицы .
Ph=pk+lg (HCO3)/(H2CO3) Зр=ЗЛ
PH=PKa+-1
Расчет рН протолитических систем.




 32.Расчет рН протолитических систем. Вывод уравнения Гендерсона- Гассельбаха и его анализ. Зона буферного действия.
32.Расчет рН протолитических систем. Вывод уравнения Гендерсона- Гассельбаха и его анализ. Зона буферного действия.
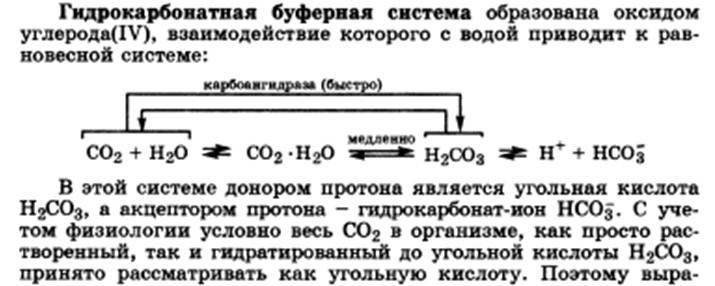 33.Буферные системы крови: гидрокарбонатная буферная система. Состав, механизм действия, биологическая роль.
33.Буферные системы крови: гидрокарбонатная буферная система. Состав, механизм действия, биологическая роль.

 34.Буферные системы крови: фосфатная буферная система. Состав, механизм действия, биологическая роль.
34.Буферные системы крови: фосфатная буферная система. Состав, механизм действия, биологическая роль.




 35.Буферные системы крови: гемоглобиновая буферная система. Состав, механизм действия, биологическая роль
35.Буферные системы крови: гемоглобиновая буферная система. Состав, механизм действия, биологическая роль
36. Буферные системы крови: протеиновая буферная система. Состав, механизм действия, биологическая роль.
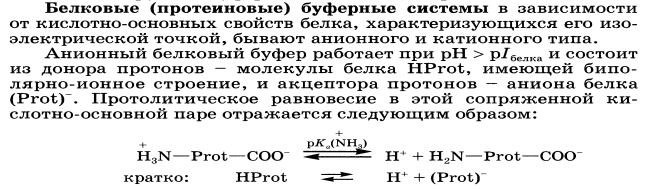

Белковая буферная система — главный внутриклеточный буфер. Он составляет примерно три четверти буферной ёмкости внутриклеточной жидкости. Компонентами белкового буфера являются слабодиссоциирующий белок с кислыми свойствами (белок-СООН) и соли сильного основания (белок-COONa). При нарастании уровня кислот они взаимодействуют с солью белка с образованием нейтральной соли и слабой кислоты. При увеличении концентрации оснований реакция их происходит с белком с кислыми свойствами. В результате вместо сильного основания образуется слабоосновная соль.
Понятие о кислотно-основном состоянии организма. Ацидоз. Алкалоз. Щелочной резерв крови. Применение реакции нейтрализации в фармакотерапии: лекарственные средства с кислотными и основными свойствами (гидрокарбонат натрия, оксид и пероксид магния, трисамин и др.).

«Щелочной резерв» — это количество бикарбоната (NaHC03) (точнее объем С02, который может быть связан плазмой крови). Эту величину лишь условно можно рассматривать как показатель кислотно-щелочного равновесия, так как, несмотря на повышенное или пониженное содержание бикарбоната, при наличии соответствующих изменений Н2С03 рН может оставаться совершенно нормальным. При тяжелых состояниях ацидоза, которые невозможно компенсировать, определение щелочного резерва все же дает важные указания. Единственно надежным методом является прямое определение рН посредством потенциометра с усилителем.













Одной из важнейших сторон гомеостаза является стремление организма для каждой из его жидкостей и клеток поддерживать определенную оптимальную концентрацию ионов водорода - рН, например, в клетках простаты рН=4,5, в остеобластах рН=8,5. Значение рН крови отличается высоким постоянством: венозная кровь - рН=7,36 - 7,38, артериальная кровь - рН=7,4.
Сохранение постоянства кислотности жидких сред имеет для организма первостепенное значение, потому что:
1. Ионы Н+ оказывают каталитическое действие на многие биохимические превращения.
2. Ферменты и гормоны проявляют биологическую активность при строго определенных значениях рН.
3. Даже небольшое изменение концентрации ионов Н+ в крови и межтканевой жидкости ощутимо влияет на величину осмотического давления в этих жидкостях.
Поддержание постоянного уровня рН в крови и тканевых жидкостях достигается с помощью регуляторных механизмов, включающих несколько буферных систем, работу легких и почек.
Респираторные расстройства КОС. Начинаются с изменения парциального давления С02 - рС02. Для компенсации включаются буферные или почечные механизмы, которые приводят к изменению концентрации НС03", способствующим восстановлению рН до исходных, хотя и не всегда нормальных величин.
Изменение парциального давления С02 связано с нарушением функции дыхания, гипо- или гипервентиляцией легких, в результате чего возникают дыхательный ацидоз или алкалоз.
Дыхательный ацидоз: возникает в результате гиповентиляции из-за:
1) заболевания легких и дыхательных путей (пневмония, отек легких, инородные тела в верхних дыхательных путях и др.);
2) повреждения (заболевания) дыхательной мускулатуры;
3) угнетение дыхательного центра в результате применения лекарственных средств или наркотиков.
Дыхательный алкалоз: возникает в результате гипервентиляции легких из-за:
1) лихорадочного состояния или истерии;
2) при вдыхании чистого кислорода или компенсаторной одышке.
Метаболические расстройства КОС. Вызываются изменениями содержания в плазме НС03~. Они индуцируют дыхательный ответ, который приводит к компенсаторному (или вторичному) изменению рС02, в результате чего восстанавливается исходный (или нормальный) уровень рН.
Метаболический ацидоз приводит к нескомпенсированному или частично компенсированному падению рН крови. Метаболический ацидоз наступает в следствие:
1) избыточного введения или образования стойких кислот (поступление кетокислот при голодании и диабете, повышение содержания молочной кислоты при шоке, повышение содержания H2S04 при усиленном катаболизме, т. е. в процессе распада биомолекул;
2) неполного удаления кислот при почечной недостаточности;
3) избыточной потери НС03" в результате поноса, колита, язвы кишечника.
Метаболический алкалоз возникает в результате:
1) потери Н+ (высокая кишечная непроходимость, рвота и др.);
2) увеличения концентрации НС03" (потеря воды, введение солей органических кислот, метаболирующих с поглощением Н+).
Компенсации этого явления достигают снижением легочной вентиляции (соответственно, задержки СО )э удалением НС03" почками.
Таблица № 8
| Тип расстройства | Первичные изменения | Вторичные и компенсаторные изменения |
| Метаболический ацидоз | X конц. НС03" | Снижение рС02 |
| Метаболический алкалоз | t конц. НС03- | Повышение рС02 |
| Респираторный ацидоз | tpC02 | Повышение конц. НС03" |
| Респираторный алкалоз | ipCQ2 | Снижение конц. НС03" |
Дифференцировать разновидности нарушений кислотно-основного состояния при их декомпенсированном течении можно основываясь на определении двух показателей: рН мочи и содержания бикарбонатов плазмы крови. Более тонкая дифференциация может быть проведена на основании определения:
pC02, BE, НС03", их значения в норме:
рС02 - парциальное давление С02 составляет:
артериальная кровь 35-45 мм рт. ст.
38. Гетерогенные реакции в растворах электролитов. Константа растворимости. Конкуренция за катион или анион: изолированное и совмещенное гетерогенные равновесия в растворах электролитов. Общая константа совмещенного гетерогенного равновесия. Условия образования и растворения осадков 






 39.Реакции, лежащие в основе образования неорганического вещества костной ткани гидроксидфосфата кальция. Механизм функционирования кальций-фосфатного буфера.
39.Реакции, лежащие в основе образования неорганического вещества костной ткани гидроксидфосфата кальция. Механизм функционирования кальций-фосфатного буфера.
Коллоидный CaHPO4 , окруженный белками и гидратной оболочкой , вместе с током крови направляется в сторону костной ткани , где в остеобластах происходит конечный этап образования костной ткани -минерализация . Способствующие факторы ph=8 , повышенная концентрация фосфат-ионов , образующихся при гидролизе сложных эфиров фосфорной кислоты , углеводов , аморфного фосфата кальция .
Формирование костной ткани – результат протекания процессов осаждения-минерализации и растворения – деминерализации. Около 30%  костной ткани составляют органические соединения, в основном коллагеновые волокна, 70 % - неорганические вещества (дентин содержит около 75% неорганического вещества и имеет очень большую плотность). Основным минеральным компонентом костной и зубной ткани является основная соль- гидроксифосфат кальция Ca5(PO4)3OH (точнее Ca10(PO4)6(OH)2 - гидроксиапатит).
костной ткани составляют органические соединения, в основном коллагеновые волокна, 70 % - неорганические вещества (дентин содержит около 75% неорганического вещества и имеет очень большую плотность). Основным минеральным компонентом костной и зубной ткани является основная соль- гидроксифосфат кальция Ca5(PO4)3OH (точнее Ca10(PO4)6(OH)2 - гидроксиапатит).
Образование костной ткани начинается с плазмы крови и включает несколько стадий: При физиологическом значении рН крови (7,4) в системе сосуществуют ионы 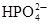 (30%) и
(30%) и 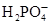 .(70%).
.(70%).
Однако, в первую очередь в присутствии ионов Ca2+ образуется менее растворимый CaHPO4 (конкуренция анионов за катион):
1-я садия: Ca2+ + 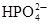 ⇄ CaHPO4
⇄ CaHPO4 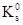 (СаНPO4) = 2,7×10–7
(СаНPO4) = 2,7×10–7
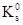 Ca(Н2PO4)2= 1×10–3
Ca(Н2PO4)2= 1×10–3
Коллоидный CaHPO4 , окруженный белками и гидратной оболочкой, вместе с током крови направляется в сторону костной ткани, где в остеобластах происходит конечный этап образования костной ткани - минерализация. Способствующие факторы: рН=8, повышенная концентрация фосфат- ионов, образующихся при гидролизе сложных эфиров фосфорной кислоты, углеводов, аморфного фосфата кальция.
2-я стадия : 3CaHPO4 + 2OH– + Ca2+⇄ Ca4Н(PO4)3 + 2H2O
Са3(РО4)2×СаНРО4
3-я стадия: Ca4H(PO4)3 + 2OH– + Ca2+⇄ Ca5(PO4)3ОН + Н2О
Растворимость электролитов в ряду
CaHPO4®Ca4H(PO4)3®Ca5(PO4)3OH
постоянно понижается, что способствует образованию термодинамически устойчивой в условиях организма формы фосфата кальция:
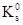 Са3(РО4)2 = 2×10–29,
Са3(РО4)2 = 2×10–29, 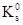 Са5(РО4)3ОН = 1,6×10–58
Са5(РО4)3ОН = 1,6×10–58
В поверхностных слоях кости содержится небольшое количество аморфного Са3(РО4)2, который придает гибкость костной ткани и является лабильным резервом кальция и фосфатов в организме. По мере взросления и старения организма его содержание уменьшается.
Костная ткань выполняет роль своеобразного минерального депо. содержащего катионы практически всех металлов, присутствующих в организме.
Часть ионов Ca2+ в костной ткани замещена ионами Mg2+. Незначительная часть ионов OH– замещена ионами фтора. Это приводит к уплотнению кристаллической решетки, а следовательно, к увеличению твердости и повышению устойчивости соединения к действию кислот ( фторид-ион - менее сильное основание Бренстеда по сравнению с гидроксид-ионом).Явление замещения ионов в узлах кристаллической решетки другими ионами, имеющими сходные кристаллохимические характеристики, называется изоморфизмом.
Таким образом, помимо гидроксиапатита в состав костной ткани входят и другие неорганические минералы:
CaНPO4  2H2O- гидрофосфат кальция (брушит)
2H2O- гидрофосфат кальция (брушит)
Ca5(PO4)3F- фторапатит (в составе зубной эмали)
Ca10(PO4)6СO3 – карбонапатит
Ca8H2 (PO4)6 ∙ 5H2O- октакальция фосфат
Mg10(PO4)6(OH)2
Ca3(PO4)2 – аморфный фосфат кальция
. Механизм функционирования кальций-фосфатного буфера.
В стоматологической практике как компонент биокерамики и в качестве имплантата костной ткани используют поликристаллический синтетический гидроксиаппатит, благодаря его уникальной биосовместимости чрезвычайно низкой растворимости .
Обмен ионами кальция в организме составляет до 800мг/сут . Концентрация ионов кальция в плазме крови постоянна и составляет 0,0025М, а фосфатов – 0,001М. Только половина кальция находится в ионизированном состоянии, другая половина связана с белками плазмы. Поддержание концентрации ионов кальция на постоянном уровне обеспечивает костная ткань и плазма крови; эту систему можно рассматривать как кальциевый буфер. Плазма крови представляет собой почти насыщенный раствор гидрофосфата кальция (CaHPO4), находящийся в динамическом равновесии с неорганическими составными частями костной ткани, поэтому костная ткань не растворяется. Полная перестройка костной ткани происходит каждые 10 лет.
При увеличении концентрации ионов Са2+ в плазме крови согласно принципу Ле- Шателье наблюдается сдвиг равновесия, приводящий к отложению кальция в костной ткани. Наоборот, снижение концентрации ионов Са2+ в плазме крови приводит к смещению равновесия в сторону растворения минеральных компонентов костной ткани, ее обызвествлению. Например, при рахите из-за недостаточности всасывания ионов Са2+ из желудочно-кишечного тракта, при беременности концентрация ионов Са2+ в плазме крови поддерживается постоянной за счет мобилизации (высвобождения) ионов Са2+ из неорганических компонентов костей. Растворение костной ткани происходит в специальных клетках- остеокластах, чему способствуют: уменьшение рН, увеличение концентрации лактатов, цитратов, белков, комплексно связывающих ионы кальция, отсутствие в пище витамина Д, . являющегося проводником кальция в составе растворимого комплекса через стенки кишечника в плазму.
 40.Явление изоморфизма: замещение в гидроксидфосфате кальция гидроксид-ионов на ионы фтора, ионов кальция на ионы стронция. Остеотропность металлов. Реакции, лежащие в основе образования конкрементов: уратов, оксалатов, карбонатов. Применение хлорида кальция и сульфата магния в качестве антидотов.
40.Явление изоморфизма: замещение в гидроксидфосфате кальция гидроксид-ионов на ионы фтора, ионов кальция на ионы стронция. Остеотропность металлов. Реакции, лежащие в основе образования конкрементов: уратов, оксалатов, карбонатов. Применение хлорида кальция и сульфата магния в качестве антидотов.



 Изоморфизм-явление возникшее в результате замещения частиц одного компонента в узлах кристаллической решетки частицами другого компонента .
Изоморфизм-явление возникшее в результате замещения частиц одного компонента в узлах кристаллической решетки частицами другого компонента .
Оксалаты : CaC2O4+2HCL=CaCL2+H2C2O4 реагирует с сильными кислотами .
Кальциноз сосудов -отложение карбоната кальция на стенках сосудов . Ca+CO3=CaCO3
В организме человека помимо фосфатов , ионы Са могут образовываться и другие малорастворимые соединения -патологические кокременты . Локально повышение концентраций некоторых ионов может наблюдаться при различных нарушениях обмена веществ .
Мочекаменная болезнь .
1) Образование уратов кальция (солей мочевой кислоты ) при рн <7
2) Образование фосфатов кальция при рн>7Ca+PO4=Ca3(PO4)2
Увеличение концентрации ионов лития приводит к уменьшению концентрации ионов натрия, что необходимо для поддержания значений ионной силы плазмы и осмотического давления. Уменьшение концентрации ионов натрия приводит к частичному растворению уратов натрия (соответственно принципу Ле Шателье).
