Схема синтеза белка на рибосомах
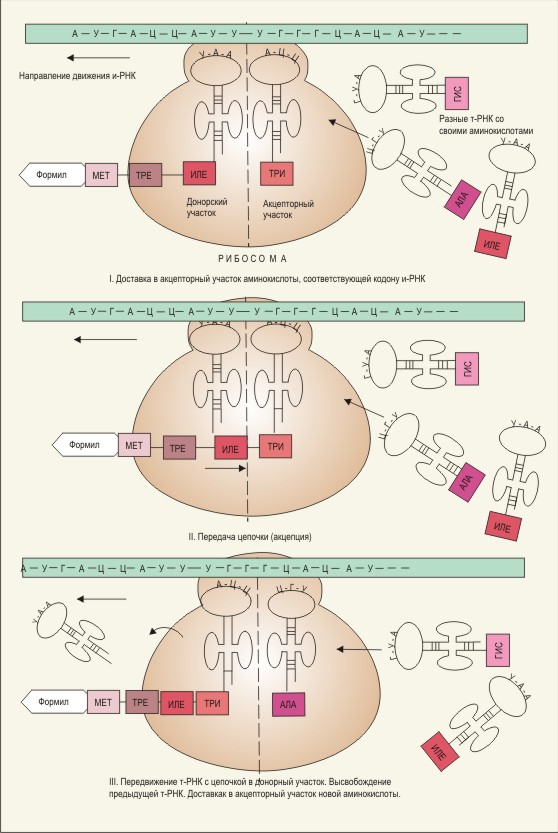
Трансляцией (от слова «перевод») называется синтез полипептидных цепей белка по матрице иРНК. Синтез иРНК, которая несет к рибосомам сведенья о первичной структуре белка, происходит в ядре клеток. Затем иРНК, пройдя через поры ядерной оболочки, направляется к рибосомам, где и происходит расшифровка генетической информации (перевод с языка нуклеотидов на язык аминокислот).
Функция рибосомы заключается в том, чтобы удержать в нужном положении иРНК и комплекс тРНК с аминокислотой до тех пор, пока между соседними аминокислотами не образуется пептидная связь. При этом малая часть рибосомы фиксирует положение иРНК и тРНК, а большая – катализирует образование пептидной связи. Таким образом, на рибосоме имеются 3 различных участка: один для иРНК и два – для тРНК. Из двух последних один участок донорный Р-участок (пептидил-тРНК-связывающий), который держит молекулу тРНК, присоединенную к растущему концу полипептидной цепи, а другой – акцепторный А-участок (аминоацил-тРНК-связывающий), с которым соединяется только что прибывшая тРНК с аминокислотой.
Как и в других реакциях полимеризации, протекающих по цепному механизму, в биосинтезе белков можно выделить три стадии: инициирование, рост цепи и обрыв цепи. Как показывает генетический код, существует только один кодон инициирования AUG, кодирующий начало полипептидной цепи с метионина. начала цепи.
Цепь начинается не с самого начала иРНК, а после какого-то участка переменной длины, потому что инициирующий кодон часто кодирует реакцию не со свободным метионином, а с формил-метионином, специально этерифицированным для инициирования иРНК, которая несет антикодон.
Интересно, что аминогруппа метонина, которая становится N-концевой группой белка, защищена в виде амида так же, как защищается аминогруппа от вступления в реакцию, если эта реакция проводится в пробирке.
Таким образом, на стадии инициирования иРНК, N-формилметионил-тРНК и рибосома связываются между собой. Это происходит в следующей последовательности:
сначала иРНК, выйдя в цитозоль, прикрепляется к малой субчастице рибосомы с помощью ионов магния; затем к ней, к ее стартовому кодону АUG присоединяется первая (инициаторная) тРНК, несущая метионин, и только после этого к ним присоединяется большая субъединица рибосомы, на которой теперь может идти синтез белка (для включения метионина во внутренние участки полипептидной цепи используются другие тРНК).
Поскольку рост белковой молекулы – это процесс удлинения (элонгации) белковой цепи за счет образования пептидных связей между аминокислотами, то эта реакция должна повторяться столько раз, сколько аминокислотных остатков входит в состав белковой молекулы.
Таким образом, синтез любого белка, то есть стадию роста цепи, можно представить в виде циклов, каждый из которых делят на три этапа:
1) Присоединение комплекса «аа-тРНК» к свободному участку рибосомы (А-участок) за счет спаривания оснований антикодона тРНК с основаниями кодона иРНК.
2) Образование пептидной связи между С-концом (карбоксильной группой) полипептидной цепи и аминогруппой аминокислоты, присоединенной к молекуле тРНК, находящейся на А-участке.
3) Передвижение рибосомы вдоль молекулы иРНК на три нуклеотида в направлении 51 – 31. Этот процесс называется транслокацией, при котором тРНК, к которой теперь присоединен растущий белок перемещается вместе с кодоном иРНК в донорный участок (Р-участок), освобождая тРНК-1 и акцепторный участок для новой тРНК-2.
На новую тРНК-2, связанную с аминокислотой, которая шифруется очередным кодоном на иРНК, переносится с донорного участка оторвавшаяся полипептидная цепь, которая удлиняется еще на одно звено. Каждая новая аминокислота, входя в цепь, присоединяется к С-концу белковой цепи. Этим биосинтез белков отличается от синтеза белков в лаборатории, когда белковая цепь удлиняется по N-концевой группе.
Обрыв цепи в реакции синтеза белка происходит в тот момент, когда в него включаются один из трех терминирующих кодонов. Это своеобразный знак препинания между генами. Дело в том, что не существует антикодонов, комплементарных нуклеотидам знаков препинания. Полипептидная цепь, оторвавшаяся в донорном участке, в этом случае уже ни к чему не присоединяется в акцепторном участке и покидает рибосому. Затем этерифицированная на конце длинная белковая цепь гидролизуется до кислоты, а инициирующий N-формилметионин удаляется. Рибосомы, иРНК и Трнк диссоциируют и готовы вновь соединиться для нового синтеза. Высокая слаженность всех «служб комбината» по по производству белков позволяет в течение нескольких секунд синтезировать полипептидные цепи, состоящие из сотен аминокислот.
Для увеличения производства белков иРНК часто присоединяется не к одной, а к нескольким рибосомам. Такая структура – одна иРНК и несколько рибосом – называется полисомой. На каждой рибосоме этом, похожем на нитку бус конвейере, синтезируются одинаковые белки.
Итак, весь процесс трансляции (синтеза полипептидной цепи на иРНК) можно разделить на следующие этапы:
1) Присоединение иРНК к рибосоме.
2) Активация аминокислоты и присоединение ее к тРНК с образованием комплекса (аминоацил-тРНК).
3) Транспорт этого комплекса к рибосоме и инициация синтеза полипептидной цепи.
4) Удлинение (элонгация) полипептидной цепи.
5) Окончание роста полипептидной цепи (терминация) и освобождение белковой молекулы от рибосомы.
Биосинтез углеводов
Биосинтез глюкозы (глюконеогенез) – это синтез глюкозы из веществ не углеводной природы − аминокислот, лактата, пирувата, субстратов цикла Кребса и глицерина.
Гликонеогенез обеспечивает потребность организма в глюкозе в тех случаях, когда нехватка в глюкозе не компенсируется гликогеном печени.
Ниже рассмотрен процесс образования глюкозы из пирувата, так как в него легко превращается такая аминокислота как аланин, а также молочная кислота, которая поступает в значительных количествах в кровь из мышц после физической нагрузки, и в печени она под действием лактатдегидрогеназы превращается в пируват:
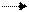 CH3-CH-COOH + НАД+ CH3-C-COOH + НАДН Н+
CH3-CH-COOH + НАД+ CH3-C-COOH + НАДН Н+
 |  |
О
Пируват в печени частично окисляется, а частично превращается в глюкозу (цикл Кори) или глюкозно-лактатный цикл.
|
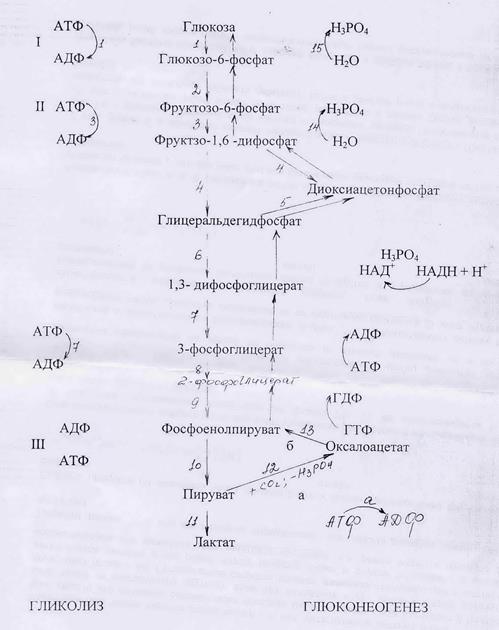
Глюконеогенез в основном протекает по такому же пути, что и гликолиз, но в обратном направлении. Однако, поскольку 3 реакции гликолиза необратимы −стадии I, II, III (схема), то на этих стадиях реакции гликонеогенеза отличаются от реакций гликолиза По сравнению с гликолизом процесс гликонеогенеза имеет 3 обходных пути.
Необратимая стадия III - превращение пирувата в фосфоенолпируват существляется в 2 стадии.через промежуточное образование оксалоацетата (ЩУК). Стадия «а» происходит при участии фермента пируваткарбоксилазы, а стадия «б» −карбоксикиназы:
COOH COOH
 | |||
 | |||
 а) C=O + CO2 + АТФ + H2O C=O + АТФ + H3PO4
а) C=O + CO2 + АТФ + H2O C=O + АТФ + H3PO4
 | |||
 | |||
CH3 CH2
 |
COOH
COOH COOH
 |  |
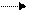 б) C=O + ГТФ C-PO3H2 + CO2 + ГДФ
б) C=O + ГТФ C-PO3H2 + CO2 + ГДФ
 |  |  |
|
 |
COOH
Две другие необратимые стадии (II, I) –реакции 14, 15, представляют собой реакции гидролиза, которые катализируются фосфатазой фруктозо-1,6- дифосфата и фосфатазой глюкозо-6-фосфата, ведут к высвобождению фосфорной кислоты и образованию глюкозы:
фруктозо-1,6- дифосфат + Н2О→ фруктозо-6- фосфат + Н3РО4
глюкозо-6-фосфат + Н2О→ глюкоза + Н3РО4
На каждую молекулу лактата при глюконеогенезе расходуется 3 молекулы АТФ
(точнее две молекулы АТФ и одна ГТФ), и поскольку для образования глюкозы (С6) необходимо 2 молекулы лактата (С3), то суммарный процесс глюконеогенеза можно записать таким образом:
2 лактата + 6 АТФ + 6Н2О → глюкоза + 6 АДФ + 6 Н3РО4
Образовавшаяся глюкоза может вновь поступать в мышцы и там превращаться в молочную кислоту.
Если записать в общем виде реакцию гликолиза:
глюкоза + 2 АДФ + 2 Н3РО4 → 2 лактата + 2 АТФ + 2 Н2О
и сопоставить эту реакцию с реакцией глюконеогенеза, то видно, что в результате цикла Кори работающие мышцы добывают 2 молекулы АТФ за счёт расходования 6 молекул АТФ в печени.
Вся имеющаяся в организме глюкоза, как поступающая в пищу, так и синтезирующиеся внутри организма, в конечном итоге окисляется до СО2 и Н2О аэробным путём. Анаэробный распад служит вспомогательным путём использования энергии глюкозы, имеющим либо локальное (например, в эритроцитах) или временное ситуационное (в работающей мышце) значение; и продукт анаэробного распада − молочная кислота − в конечном итоге тоже может окислятся аэробным путём.
В организме человека за сутки может синтезироваться около 80г глюкозы, главным образом в печени, а также в корковом веществе почек и слизистой оболочке кишечника.
Биологическое значение гликонеогенеза заключается не только в возвращении лактата в метаболический фонд углеводов, но и в обеспечение глюкозой мозга при недостатке углеводов в организме.
Биосинтез гликогена
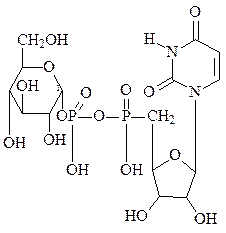
Значительная часть глюкозы, поступающей в клетки при пищеварении превращается в гликоген – животный крахмал −запасной полисахарид, который используется в интервалах между приёмами пищи. Он сходен по строению с крахмалом. Непосредственным донором глюкозных остатков при синтезе гликогена служит уридиндифосфатглюкоза (УДФ-глюкоза)−продукт взаимодействия глюкозо-1-фосфата и УТФ.
 |
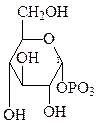
|
|
При синтезе гликогена роль акцептора глюкозных остатков выполняют олигосахариды из 2-х и более глюкозных остатков, связанные 1,4-гликозидной связью, или уже имеющиеся молекулы гликогена:
 УДФ-глюкоза + (глюкоза)n УДФ + (глюкоза)n+1
УДФ-глюкоза + (глюкоза)n УДФ + (глюкоза)n+1
Реакцию катализирует гликогенсинтетаза, при этом образуются 1,4-гликозидные связи в линейных участках молекулы гликоген. Ответвления возникают в результате действия фермента ветвления (амило-1,4-1,6-гликозилтрансферазы). Этот фермент переносит фрагмент из пяти-семи мономеров с конца линейного участка ближе к его середине, который присоединяется 1,6-гликозидной связью. Затем оба конца удлиняются при участии гликогенсинтазы, и на них вновь возникают ветвления.
Таким путем синтезируются огромные молекулы с молекулярной массой от 1млн до 200млн, содержащие до 1 млн глюкозных остатков.
В клетке гликоген находится не в растворённом состоянии, а в виде гранул диаметром 40- 200 нм, включающих одну или несколько молекул.
Необходимость превращения глюкозы в гликоген при запасании энергетического материала обусловлено тем, что накопление легко растворимой глюкозы в клетках могло бы привести к осмотическому шоку и разрушению клеточной мембраны. Запасание гликогена связано с расходом 2-х молекул АТФ на каждую молекулу глюкозы, которая включается в гликоген.
|
 Глюкоза
Глюкоза
|
 Глюкозо-6-фосфат
Глюкозо-6-фосфат
|
 Глюкозо-1-фосфат
Глюкозо-1-фосфат
|
 УДФ-глюкоза
УДФ-глюкоза
 |
|
|
Гликоген образуется практически во всех клетках организма, однако наибольшая концентрация обнаруживается в печени − от 2 до 6 % и в мышцах − от 0,5 до 2 %. Поскольку общая масса мышц велика, больше всего по массе гликогена содержится в мышцах. Глюкоза, которая депонирована в форме гликогена, освобождается при помощи фермента гликогенфосфорилазы. Голодание в течениеи24 часов приводит к почти полному исчезновению гликогена в клетках печени. Однако при ритмичном питании каждая молекула гликогена может существовать неопределенно много времени.
Биосинтез жиров
Включает в себя биосинтез жирных кислот и триацилглицеридов (собственно, жиров).
Биосинтез жирных кислот.
Биосинтез жирных кислот происходит при высокой концентрации глюкозы в крови в основном в печени и в жировой ткани. В этот период активируется гликолиз, в результате которого образуются субстраты для синтеза жирных кислот: ацетил КоА, АТФ, (НАДФ·Н + Н+) и другие. Основным строительным блоком для биосинтеза жирных кислот служит ацетил КоА, а главным конечным продуктом является пальмитиновая кислота С15Н31СООН.
Другие жирные кислоты образуются, как правило, путём модификации молекулы пальмитиновой кислоты – наращиванием цепи и дегидрированием. В последнем случае образуются непредельные кислоты.
Синтез пальмитиновой кислоты происходит не в митохондриях, где происходит катаболизм жирных кислот, а в цитозоле. Основным ферментом этого биосинтеза служит мультиферментный комплекс пальметилсинтетаза. Так как мембрана митохондрии непроницаема для ацетил КоА, то начальным этапом биосинтеза является перенос ацетил КоА через митохондриальную мембрану с помощью цитратпируватного челночного механизма.
Известно, что первой реакцией цикла Кребса является конденсация ацетил КоА с щавелевоуксусной кислотой (оксалоацетатом) с образованием цитрата (лимонной кислоты). Часть образовавшихся цитрат-ионов не вовлекается в дальнейшие реакции цикла Кребса, а переносятся через митохондриальную мембрану в цитозоль, где в присутствии цитратлиазы и при участии АТФ и HS-KoA вновь образует ацетил-КоА и ЩУК :
Цитрат + HS-KoA + АТФ → Оксалоацетат + Ацетил-КоА + АДФ + Н3РО4
Возвращение оксалоацетата в митохондрии осуществляется с помощью двух посредников − малата и пирувата
Восстановление оксалоацетата в малат в цитозоле является частью малатаспартатного челночного механизма переноса восстановленного (НАД∙Н + Н+) из цитозоля в митохондрии:
Оксалоацетат + НАД∙Н + Н+ ↔ Малат + НАД
Однако образовавшийся малат не переносится с\через мембрану, а сразу окисляется с одновременным декарбоксилированием в пируват:
Малат + НАДФ+ → Пируват + СО2 + НАДФ∙Н + Н+
Все описанные превращения изображены на схеме:
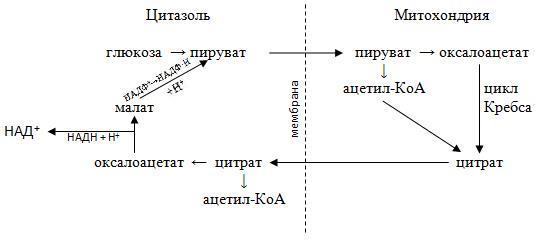
Таким образом, перенос одной молекулы ацетил КоА из митохондрии в цитозоль сопровождается образованием одной молекулы восстановленной формы (НАДФ·Н + Н+), который необходим для многих биосинтезов, а пируват, который дифундирует в митохондрии, затем карбоксилируется с образованием оксалоацетата.
Собственно синтез пальмитиновой кислоты начинается с карбоксилирования ацетил КоА. Эта реакция протекает в присутствии фермента, простетической группой которого является биотин:
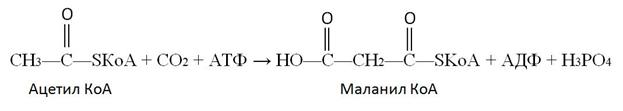
Эта реакция является ключевой в синтезе жирных кислот. Дальнейшие превращения объединяются в циклы по шесть реакций, и в результате завершения каждого цикла углеродная цепь будущей молекулы удлиняется на два углеродных атома.
Рассмотрим реакции, протекающие в первом цикле синтеза жирных кислот.
В первых двух реакциях происходит перенос ацетильного и малонильного фрагментов на ацилпереносящий белок (АПБ).
АПБ представляет собой полипептидную цепь, состоящую из 77 аминокислотных остатков и бокового ответвления, повторяющую по существу структуру кофермента А:
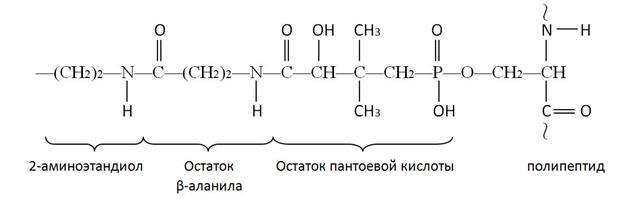
Реакции переноса ацетильного и малонильного фрагментов с ацетил-КоА (1) и малонил-КоА (2) катализируются ацилтрансферазами.
3-ья реакция состоит в образовании ацетоацетил-АПБ из ацетил-АПБ и маонил-АПБ с одновременным декарбоксилированием.
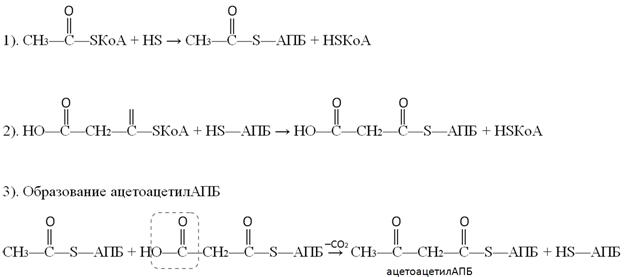
В дальнейшем в три этапа (реакции 4-6) происходит восстановление образовавшегося ацетоацетил-АПБ.
В ходе 4-ой реакции одна из двух карбонильных групп восстанавливается до гидроксильной и образуется дегидроксибутерил-АПБ. Эта реакция является НАДФ–зависимой, т.е. восстановителем служит восстановленная форма НАДФ:
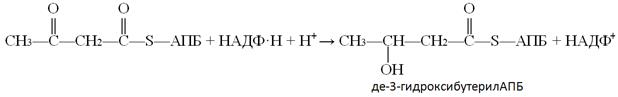
5-ая реакции - реакция дегидратации, ферментом этой реакции является гидроксиацил-АПБ-дегидратаза:
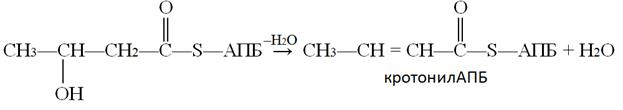
Следующая реакция восстановления (6) – реакция гидрирования – также требует участия НАДФ∙Н + Н+. Катализируется она еноил-АПБ-редуктазой, продуктом реакции являетотся бутирилАПБ:
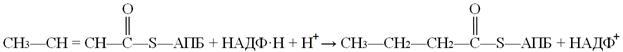
Все реакции цикла элонгации (удлинения) цепи жирных кислот катализируются мультиферментным комплексом. Он состоит из двух полипептидных цепей. Одна из них (субъединица А) включает АПБ, оксоацил-АПБ-синтазу и оксоацил-редуктазу. В составе субъединицы Б находятся 4 других фермента. Согласованная работа мультиферментного комплекса обусловлена наличием в молекуле АПБ большого рычага – гибкой и достаточно длинной цепочки атомов, соединяющей «якорную» HS-группу с полипептидной цепью
Синтез пальмитиновой кислоты включает 7 циклов. Во второй цикл вместо ацетил-АПБ вступает уже бутирил-АПБ (С4-ацил), и в результате образуется каприл-АПБ (С6-ацил) и т.д. (схема):
1-ый цикл: малонил-АПБ + ацетил_АПБ
↓
2-ой цикл: малонил-АПБ + бутирил-АПБ
↓
3-ий цикл: малонил-АПБ + каприл-АПБ
↓
4-ый цикл: малонил-АПБ + С8-ацил-АПБ
↓
5-ый цикл: малонил-АПБ + С10-ацил-АПБ
↓
6-ой цикл: малонил-АПБ + С12-ацил-АПБ
↓
7-ой цикл: малонил-АПБ + С14-ацил-АПБ
↓
пальмитил-АПБ
Суммарное уравнение биосинтеза пальмитиновой кислоты из ацетил-КоА в результате реакций семи циклов записывается следующим образом:
8 ацетил-Коа + 7 АТФ + 14 (НАДФ∙Н + Н+) → пальмитат + 14 НАДФ+
+ 8 НS-КоА + 7 АДФ + 7 Н3РО4
Из пальмитиновой кислоты путем присоединения дополнительно одной или нескольких молекул ацетил-КоА синтезируюся молекулы с более длинными цепями, а путем дегидрирования – ненасыщенные кислоты. «Доработка» молекул пальмитиновой кислоты осуществляется с помощью ферментов эндоплазматической сети, но может проходить и в митохондриях. Дегидрирование насыщенной жирной кислоты происходит параллельно с окислением НАДФ под действием молекулярного кислорода:
С15Н31СОО-S-КоА + НАДФ∙Н + Н+ + О2 →СН3-(СН2)5-СН=СН-(СН2)7-СОО-S-КоА +НАДФ+ + 2 Н2О
Дегидрирование насыщенных жирных кислот происходит в клетках печени и жировой ткани. В организме человека отсутствуют ферменты, позволяющие дегидрировать фрагменты –СН2-СН2-, находящиеся дальше С9, поэтому диеновая линолевая кислота
С18Н32СООН и триеновая линоленовая кислота С18Н30СООН в организме не синтезируются.
