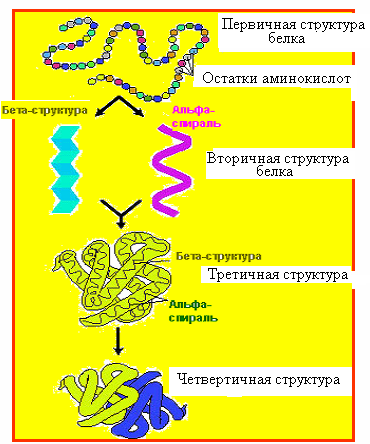
Белок молекуласының құрылымы, белоктың биологиялық қасиетінің біріншілік структурасына тәуелділігі
Белок молекуласының құрамына кіретін амин қышқылдарының саны мен сапасының әр түрлі болуы, осы класқа жататын қосылыстарға тән ерекшелік қасиеттерін және олардың құрылысының күрделілігін қамтамасыз етеді. Амин қышқылдарының жүйелілікпен тізбектелуі және белок молекуласының кеңістік құрылымы төрт деңгеймен сипатталады – бірінші, екінші, үшінші, төртінші реттік құрылым.
Бірінші реттік құрылым.Бұл амин қышқылдарының белгілі бір ретпен өзара байланысып, полипептид тізбегін түзуі. Бірінші реттік құрылымды пептидтік байланыс қамтамасыз етеді.
Әрбір полипептид тізбегінің екі шеткі амин қышқылын былай ажыратады: бос амин тобы бар амин қышқылы полипептид тізбегінің бастамасы, яғни N-басы немесе бірінші амин қышқылы болып саналады. Ал бос карбоксил тобы бар амин қышқылы С-соңы болып табылады. Осы екі амин қышқылының арасында, пептидтік байланыспен жалғасқан басқа амин қышқылдары жүйелі ретпен орналасады (сур. 4).

4 сурет – Белоктардың бірінші реттік құрылымы
Әрбір белок бірінші деңгейдегі құрылымымен өзгеше, оның бұзылуы белоктың физико-химиялық және функционалдық қасиетін өзгертеді. Белоктарға тән ерекшелігін бірінші реттік құрылымы қамтамасыз етеді. Сонымен бірге белоктардың антигендік қасиеті де бірінші деңгейдегі құрылымына байланысты. Бір ағзадан алынған белок басқа түрдегі организмге түссе де иммунологиялық жүйе арқылы қорғаныс белокты (антидене) синтездейді. Бұл белок антигенмен қосылып, бөгде белокты метаболиттік айналымнан шығарып тастауға, тұнбаға түсіруге немесе ерітіп жіберуге тырысады. Антиденемен тікелей комплекс түзуге қатысқан белоктың бөлімін антигендік детерминант деп атайды.
Екінші реттік құрылымы.Бірінші реттік құрылымын білу, белок молекуласының құрылысы мен қызметі туралы толық мәлімет бере алмайды. Екінші реттік құрылымы— полипептид тізбегінің оралып, шумақталып спираль немесе белгілі бір конформация түзу тәсілі. Бұл полипептид тізбегінің жеке бөліктерінің арасында сутектік байланыстардың түзілуі нәтижесінде пайда болады. Екінші реттік құрылымды сутектік байланыстар қамтамасыз етеді.
Екіншілік деңгейдегі құрылым екі түрге бөлінеді: α-спираль және β-құрылымы.
α-құрылым - спираль, оңға қарай ширатылып үнемі қайталанып отырады. Әрбір оралымында 3,6 амин қышқылы орналасады, қадамы 0,54 нм (сур. 5. А). α-спиральдың реттеу жиілігі 5 қадам немесе18 амин қышқылының қалдығына тең. α-спираль құрндағы сутегі атомдарының біріне бірі жақын орналасуы нәтижесінде пайда болатын сутектік байланыс қамтамасыз етеді, бағыты ось бойымен парралель болады.
Екінші түрі - β-құрылымы (сур. 5. Б) кейбір фибриллярлы белоктарға (жібек фиброины) тән, қатпарланған қабаттан түзіледі.
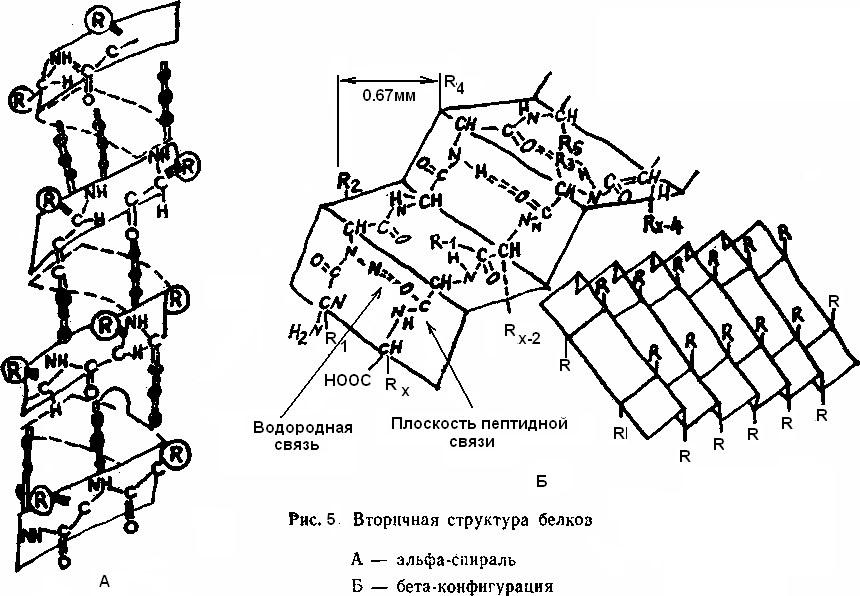

Физикалық әдістермен анықталған полипептид тізбегі гармошка тәрізді қабат-қабат болып келеді, сутектік байланыстардың бағыты өз қсіне перпендикуляр келеді. Сутектік байланыстар тек бір полипептидтік тізбекте ғана емес, әр түрлі тізбектер арасында да түзіледі. Белоктың екінші реттік құрылымы қыздырғанда бұзылуы мүмкін. Полипептид тізбегінің спираль түзуі, оның ұзындығын төрт есе кемітеді
Үшіншілік құрылымы – ең күрделі құрылым. Осы деңгейде белоктың жоғары кеңістіктік құрылымы конформациясы қалыптасады. Үшінші реттік құрылым полипептид тізбегінде пролин, оксипролин, глицин амин қышқылдарының қалдығының болуына байланысты, полипептид тізбегінің иілуінің нәтижесінде пайда болады. Үшінші реттік құрылым екі пішінде болуы мүмкін: глобулярлы және фибриллярлы. Үшінші реттік құрылымның беріктігі дисульфидтік, иондық және гидрофобты байланыстармен қалыптасады.Үшінші реттік құрылым түзілуі кезінде амин қышқылдарының гидрофобты радикалдары белок молекуласының ішіне қарай жымырылып, ал гидрофильді радикалдары сыртқы бетіне орналасады. Термодинамика тұрғысынан қарағанда мұндай конфигурация өте қолайлы болып саналады. Үшінші реттік құрылым түзу кезінде белок молекуласы оралып, шиыршықталып жинақталады. Осы кезде қайталанбайтын жоғары спецификалық, жеке белок молекуласына ғана тән конформация түзіледі.
Төртінші реттік құрылым.Бұл құрылым бірнеше полипептидтік тізбектен тұратын белок молекуласына тән. Әрбір полипептидтік тізбектің бірінші, екінші, үшінші деңгейдегі құрылымы бар. Осының нәтижесінде бір функционалды қызмет атқаратын макромолекулярлық комплекс түзіледі. Осы косплексті түзетін полипептидтік тізбекті суббірлік деп атайды. Төртінші деңгейдегі құрылымды иондық, сутектік, дисульфидтік байланыстар қамтамасыз етеді.
Рентгенқұрылымдық анализ арқылы тқртінші деңгейдегі құрылымы анықталған белок - гемоглобин. Ол төрт поипептид тізбегінен және төрт гемнен, коллаген үш полипептидтік түзбектен тұрады. Төртінші реттік құрылымның биологиялық маңызы өте зор:
1. Жинақталып макромолекулаларға айналатын, қысқа полипептид тізбектері синтезделіп, синтез кезінде қатенің азаюына ықпалын тигізеді;
2. Генетикалық материалды үнемдейді, бірдей тізбектер көптеген рибосоманы пайдалана отырып, бір м-РНК –да синтезделеді;
3. Реттеуші әсерін қалыптастырады. Төртінші деңгейдегі құрылым түзуге қатысатын жеке мономерлер бірімен бірі активті функционалды тобы жоқ гидрофобты бөлімдер арқылы әсерлеседі. Сондықтан олардың байланысы берік болмайды, болмашы әсерден тез үзіліп кетеді. Белоктардың реттік құрылымдарын түзетін байланыстарды салыстырғанда, ең мықтысы - бірінші реттік құрылым, ең әлсізі – төртінші реттік құрылым.