Биохимические механизмы токсичности лекарственных препаратов. Фармакодинамика и фармакокинетика лекарств. Факторы, влияющие на концентрацию лекарств.
Аэробное окисление глюкозы.
1. Протекает в цитозоле:
Глюкоза → 2ПВК + 2АТФ + 2НАДН2
2. Протекает в митохондриях:
2 ПВКПДК→ 2 ацетил КоА + 2НАДН2
3. Протекает внутри митохондрий:
2 ацетил КоА → 2ЦТК (12*2 = 24 АТФ)
В силу того что 2 молекулы НАДН2 на первом этапе образуются в цитозоле, а окислятся они могут только в митохондриальной дых.цепи, необходим перенос Н2 от НАДН2 во внутримитохондриальные цепи переноса эл-ов. Митохондрии непрпоницаемы для НАДН2, поэтому для переноса Н2 из цитозоля в митохондрии существуют специальные челночные механизмы. Х окисленная форма переносчика водорода, а ХН2 – его восстановленная форма::
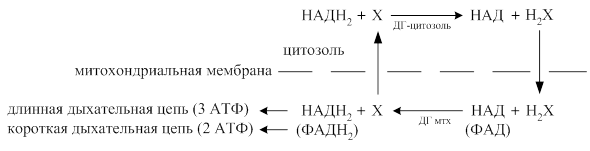
В зависимости от того какие вещества участвуют в переносе Н+ через митохондриальную мембрану различают несколько челночных механизмов:
Глицерофосфатный: происходит потеря двух молекул АТФ, т.к. вместо двух молекул НАДН2 (потенциально 6 молекул АТФ) образуется 2 молекулы ФАДН2 (реально 4 молекулы АТФ).
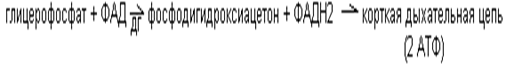
Малатный: 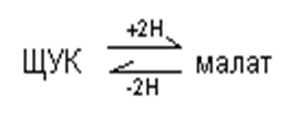
Энергитическая ценность аэробного окисления.
1. глюкоза → 2ПВК + 2АТФ + 2НАДН2 (→8 АТФ)
2. 2ПВК→ 2 ацетил КоА + 2НАДН2 (→6 АТФ)
3. 2 ацетил КоА → 2 ЦТК (12*2=24 АТФ) /если что,смотреть Цикл Кребса/
Итого 38 АТФ. Из которых надо вычесть 2 теряемые АТФ в глицерофосфатном челночном механизме = 36 АТФ.
аэроб.окисл в тридцать раз эффективнее анаэробного окисления глюкозы. Поэтому в тканях при поступлении кислорода анаэробный путь блокируется и это явление называется эффектом Постера.
Биохимические механизмы токсичности лекарственных препаратов. Фармакодинамика и фармакокинетика лекарств. Факторы, влияющие на концентрацию лекарств.
Взаимодействие токсиканта или продуктов его превращения в организме со структурными элементами биосистем, лежащее в основе развивающегося токсического процесса, называется механизмом токсического действия.Взаимодействие осуществляется за счет физико-химических и химических реакции.Токсический процесс, инициируемый1) физико-химическими реакциями, как правило, обусловлен растворением токсиканта в определенных средах (водной или липидной) клеток и тканей организма. изменяются физико-химические свойства среды-растворителя (рН, вязкость, электропроводность, сила межмолекулярных взаимодействий и т.д.). Таким образом действуют на ткани все кислоты, щелочи, сильные окислители, некоторые органические растворители и лишенные специфической активности высокомолекулярные соединения.
2механизм заключ в том,что происход.химические реакции токсиканта с определенным структурным элементом живой системы. Структурный компонент биологической системы, с которым вступает в химическое взаимодействие токсикант, называется его "рецептором" или "мишенью".
Изучением влияния, оказываемого лекарственными веществами на организм, занимается фармакодинамика.
Фармакокинетика-изучает кинетические закономерности процессов, происходящих с лекарственными средствами в организме: пути поступления лекарственных веществ в организм, их транспорт, распределение в различных органах и тканях, биотрансформацию и выведение, а также влияние на них различных факторов.
Важным фактором, влияющим на концентрацию лекарственных веществ, является их выведение из организма-
1.клиренс (мл/мин). Общий клиренс — объем плазмы крови, который очищается от препарата за единицу времени за счет выведения почками, печенью и др.
2.побочные эффекты
3.прием др.лекарств
4.заболевание,влияющие на фармакокинетику
Билет 2
1. Типы связей аминокислот в молекулах белков и их роль в стабилизации белковой структуры. Пептиды. Номенклатура пептидов, их свойства. Физиологически активные пептиды крови и других тканей человека.
В молекуле белка различают прочные, ковалентные связи: пептидные, дисульфидные и непрочные, нековалентные связи: водородные, ионные, вандерваальсовые, гидрофобные.
Пептидные связи
Пептидные связи (-СО-NН-) являются основным видом связей в белках. образуются при взаимодействии α- карбоксильной группы одной аминокислоты и α - аминогруппой другой аминокислоты. промежуточное положение между одинарной и двойной связью. Длина 0,132 нм. Вращение атомов вокруг пептидной связи затруднено, атомы О и Н в ней находятся в транс-положении. Все атомы пептидной связи располагаются в одной плоскости. Атомы О и Н пептидной связи могут дополнительно образовывать водородные связи с другой пептидной связью. Пептидные связи определяют порядок чередования аминокислот в полипептидной цепи белка, т.е. формируют первичную структуру белка. Пептидные связи – прочные связи
Дисульфидные связи
Дисульфидные связи (-S- S-) образованы двумя молекулами цистеина в составе белковой молекулы. Возможны внутрицепочечные дисульфидные «мостики» в пределах одной полипептидной цепи и межцепочечные связи между отдельными полипептидными цепями. Дисульфидные связи влияют на пространственную укладку белковой молекулы, т.е. на третичную структуру белков. Дисульфидные связи разрываются при действии некоторых восстановителей и при денатурации белка.
Водородные связи
возник. между атомом водорода и электроотрицательным атомом (чаще кислородом). в 10 раз слабее пептидных связей. возникают между атомом Н и атомом О различных пептидных связей: либо близко расположенных в молекуле белка, либо находящихся в разных полипептидных цепях. Большое количество водородных связей фиксирует в белках в основном вторичную структуру (α - спираль и β - складчатую структуру) а также участвует в образовании третичной и четвертичной структур белка. Непрочные водородные связи легко разрываются при денатурации белка.
Ионные связи
Ионные связи образуются между противоположно заряженными аминокислотами в составе белковой молекулы (положительно заряженными лизином, аргинином, гистидином и отрицательно заряженными глютаматом и аспартатом). Ионные связи влияют на пространственную укладку белков, т.е. формируют третичную и четвертичную структуры белков. Ионные связи нарушаются при изменении рН среды, при денатурации.
Вандерваальсовые взаимодействия
Вандерваальсовые взаимодействия – разновидность связей, возникающих при кратковременной поляризации атомов.
Гидрофобные связи
Гидрофобные связи возникают между неполярными (гидрофобными) радикалами аминокислот в полярном растворителе (вода). Гидрофобные радикалы погружаются внутрь белковой молекулы, меняя пространственное расположение полипептидной цепи. Гидрофобные взаимодействия имеют энтропийную природу, придают устойчивость молекуле белка, участвуя в формировании его третичной, а также четвертичной структуры.
Пептиды — это цепочечные молекулы, содержащие от двух до ста остатков аминокислот, соединенных между собой пептидными связями.
Пептиды, в молекулах кот. Меньше десяти аминокислотных остатков,-олигопептиды, пептиды, построенные из большего числа аминокислотных остатков к полипептидам.
По размеру молекул и свойств пептид стоят между высокомолекулярным белкам и аминокислотами. Наиболе распространены линейные пептиды, известны циклически пептиды. Циклические пептиды образуются из линейных, когда пептидная связь связывает амино и карбо ксильные группы N и С-концевых аминокислот
Природные пептиды и зависимости от характера действия и происхождения принято делить на 4 группы:1) Пептиды, обладающие гормональной активностью (вазопресин, окситоцин, адренокортикотропный гормон, меланоцитстимулирующий гормон, глюкагон,кальцитонин, меланоцитостимулирующий гормон и другие). Подробнее о них будет говориться в соответствующих разделах биохимии. 2) Пептиды, принимающие участие в пищеварении (гастрин, секретин). Эти гормоны синтезируются в желудке и стимулируют секрецию соляной кислоты и выделение воды и солей в поджелудочной железе.3) Пептиды, имеющие своим источником альфа-2-глобулиновую фракцию сыворотки крови (ангиотензин – регулирует кровеносное давление, брадикинин – мощное сосудорасширяющее средство, ренин – активирует ангиотензин) 4) Нейропептиды – оказывают большое влияние на передачу нервных импульсов(энкефалины)
Очень важное значение имеет трипептид глютатион. Он участвует в транспорте аминокислот через клеточные мембраны. Поддерживает восстановленное состояние железа(+2) в гемоглобине. Сохраняет интактными(неповрежденными) –SН- группы многих белков мембраны, предохраняя их от окисления.
2.Флавиновые ферменты (флавопротеиды). Окислительные реакции, протекающие с участием флавиновых ферментов. Последующие акцепторы электронов. Структура и роль ФАД и ФМН. Витамин В2.
Флавопротеиды - сложные белки, состоящие из белковой и небелковой части, представленной флавинмононуклеотидом (ФМН) или флавинадениндинуклеотидом (ФАД). Белковая часть флавопротеидов имеет большую молекулярную массу около 200 тыс. д. и прочно связывается с небелковой частью.
ФМН – флавинмононуклеотид, состоит из флавина, рибитола, Н3РО4.
ФАД – флавинадениндинуклеотид, включает флавиновый и адениловый нуклеотиды:
1. флавин – рибитол - Н3РО4.
2. аденин – рибоза - Н3РО4.
Общий вид реакции с участием флавопротеидов (2 стадии):
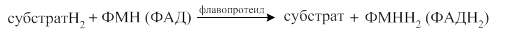

В качестве субстратов для флавопротеидов служат янтарная кислота, активные формы жирных кислот. В этом случае флавопротеиды являются первичными акцепторами протонов и электронов для этих веществ. Донором водорода для флавопротеидов может также служить молекула НАДН2. В этом случае флавопротеиды являются промежуточными акцепторами протонов и электронов. В качестве акцепторов электронов для флавопротеидов могут являться убихинон (во внутримитохондриальном окислении) или кислород (во внемитохондриальном окислении). В этом случае флавопротеиды называют не дегидрогеназами, а оксидазами. Непосредственным переносчиком протонов и электронов в составе флавопротеидов служит флавин.
Схема восстановления флавина:
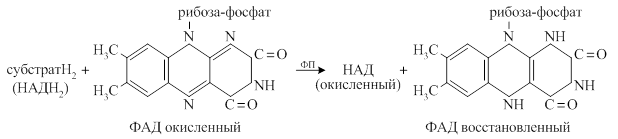
Витамин В2
Витамин В2 (рибофлавин, витамин роста) включает флавин (изоаллоксазин) и рибитол. Рибофлавин распространён в злаках, в дрожжах. Суточная потребность в нём составляет 1-2 мг. Биологическая роль – входя в состав ФМН и ФАД, участвует в биологическом окислении.
Авитаминоз проявляется в виде дерматита, катаракты, анемии, поражении сердечной мышцы
3.Гормоны коры надпочечников: глюкокортикоиды, минералкортикоиды. Гормоны мозгового слоя надпочечников. Их влияние на метаболизм. Физиологические эффекты.
