Непрямое дезаминирование , транс-дезаминирование, химизм, биологическая роль
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
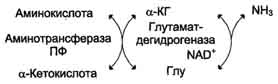
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование - основной способ дезаминирования большинства аминокислот.Обе стадии непрямого дезаминирования обратимы (рис. 9-9), что обеспечивает как катаболизм аминокислот (рис. 9-9, А), так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты (рис. 9-9, Б).
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение - дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования:
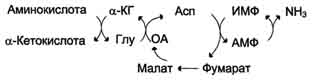
Можно выделить 4 стадии процесса:
- трансаминирование с α-кетоглутаратом, образование глутамата;
- трансаминирование глутамата с оксалоацета-том (фермент ACT), образование аспартата;
- реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
- гидролитическое дезаминирование АМФ.
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом (см. схему А на с. 476).
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы (см. схему Б на с. 476).
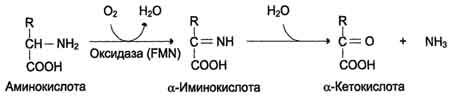
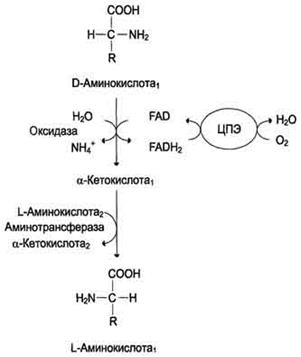
Рис. 9-8. Биологическая роль оксидазы D-аминокислот.
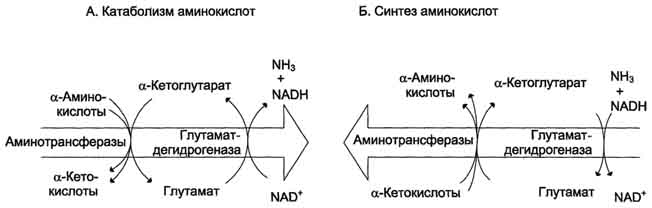
Рис. 9-9.Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты.
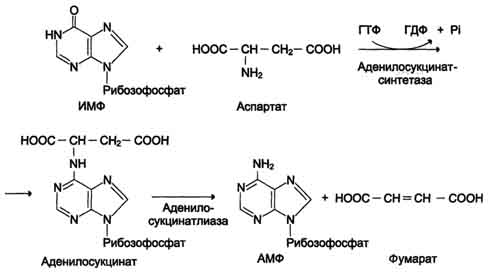
Схема А
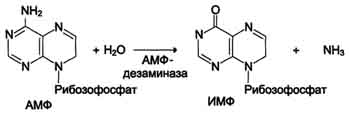
Схема Б.
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
22)Декарбоксилирование аминокислот.Процесс отщепления карбоксильной группы ак в виде СО2 и приводит к образованию биогенных аминов, которые оказывают фармакологическое действие на физиологические функции человека.
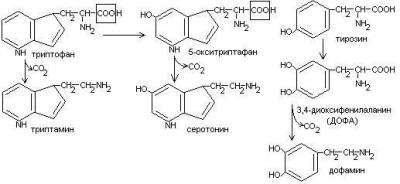
Серотонин обладает сосудосуживающим действием, участвует в регуляции артериального давления, t тела, дыхания, медиатор нервных процессов.
Дофамин- предшественник катехоламинов.
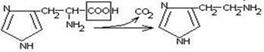
гистидин гистамин
Гистамин обладает сосудорасширяющим действием. Он образуется в области воспаления, участвует в развитии аллергических реакций.
НООС-(СН2)2-СН-СООH →СН2-СН2-СН2-СООН
| |
глутамат NH2 NH2 γ аминомасляная кислота (ГАМК)
ГАМК является тормозным медиатором. В лечебной практике используется при лечении эпилепсии (резкое сокращение частоты припадков).
Орнитин декарбоксилируясь дает диамин – путресцин, а лизин – кадаверин.
СН2-СН2-СН2-СН-СООН →СН2-СН2-СН2-СН2-NH2;
| | |
NH2 NH2 NH2
CH2-CH2-CH2-CH2-CH-COOH → СН2-СН2-СН2-СН2-CH2-NH2
| | |
NH2 NH2 NH2
