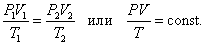Перечислить основные законы идеального газа
Теоретические основы теплотехники
Перечислить основные параметры, которыми характеризуется состояние рабочего тела
Давление с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенки сосуда, в котором заключен газ, и представляет собой отношение нормальной составляющей силы к поверхности, на которую действует сила: Р = N /F, где N - сила, Н; F - площадь поверхности, м2
Температура с качественной стороны характеризует степень нагретости тела, с количественной стороны температура является мерой интенсивности теплового движения молекул.
Удельный объем (v) – объем единицы массы вещества, м3/ кг, v = V / m, где V – полный объем вещества, м3; m - масса вещества, кг.
Объяснить, что такое идеальный газ
Под идеальным газом понимают газ, у которого отсутствуют силы взаимодействия между молекулами, а молекулы не имеют объема, т.е. представляют собой материальные точки.
Перечислить основные законы идеального газа
Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным.
Изохорический процесс. Закон Шарля. V = const. Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля: При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т= const.
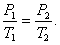
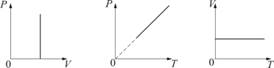
2. Изобарический процесс. Закон Гей-Люссака.Р = const. Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака: При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
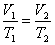
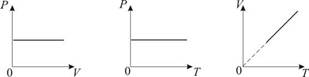
3. Изотермический процесс. Закон Бойля – Мариотта. T = const. Изотермическим процессом называется процесс, протекающий при постоянной температуре Т. Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта:При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.


4. Адиабатический процесс (изоэнтропийный): Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой.
5. Политропический процесс. Процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов.
6. Закон Авогадро. При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул. В одном моле различных веществ содержится NA=6,02·1023молекул (число Авогадро).
7. Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов: 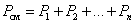 Парциальное давление Pn – давление, которое оказывал бы данный газ, если бы он один занимал весь объем.
Парциальное давление Pn – давление, которое оказывал бы данный газ, если бы он один занимал весь объем.
При 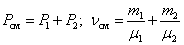 , давление смеси газов:
, давление смеси газов: 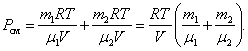
8. Объединённый газовый закон (Закон Клапейрона).
В соответствии с законами Бойля – Мариотта (1.4.5) и Гей-Люссака (1.4.3) можно сделать заключение, что для данной массы газа