Классификация и номенклатура ферментов
Современные классификация и номенклатура ферментов разработаны Комиссией по ферментам Международного биохимического союза и утверждены на V Международном биохимическом конгрессе в 1961 г. в г. Москве.
В основу классификации легли три принципа:
1. Химическая природа фермента.
2. Химическая природа субстрата, на который действует фермент.
3. Тип катализируемой реакции.
Существует шесть классов ферментов.
| СООН СООН ½ ½ НО – С – Н малатдегидрогеназа С = О ½ + НАД+ ----------------------------à ½ + НАДН + Н+ Н – С – Н ß--------------------------- СН2 ½ ½ СООН СООН L – малат оксалоацетат |
Аэробные дегидрогеназы, или оксидазы, катализируют перенос протонов (электронов) непосредственно на кислород;
Анаэробные дегидрогеназы ускоряют перенос протонов (электронов) на промежуточный субстрат, но не на кислород.
Наиболее распространены оксидоредуктазы, содержащие в качестве кофактора никотинамидадениндинуклеотид (НАД+), либо никотинамидадениндинуклеотидфосфат(НАДФ+). Их называют пиридинферментами.
Коферментами оксидоредуктаз являются также флавопротеины (ФП) – флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Подобные ферменты получили название флавиновых дегидрогеназ.
2. Трансферазы - ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов.
Фосфотрансферазыкатализируютперенос остатка фосфорной кислоты. Донором фосфатных остатков в большинстве случаев является АТФ. Фосфорные эфиры органических соединений обладают повышенной химической активностью. Реакция фосфорилирования глюкозы катализируется гексокиназой или АТФ,D-глюкоза-6-фосфотрансеразой:
Протеинкиназыпереносят остаток фосфата с АТФ на белки,изменяя их биологическую активность.
Аминотрансферазыускоряют реакцию переноса аминогруппы с аминокислоты на a-кетокислоту:
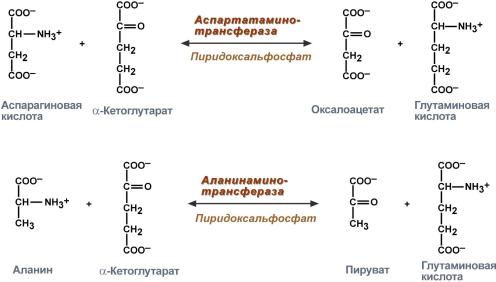
аспарагиновая α-кетоглутарат оксалоацетат глутаминовая
кислота кислота
Гликозилтрансферазыкатализируют реакции переноса гликозильных остатков; ацилтрансферазы– реакции переноса ацилов (остатков карбоновых кислот).
3. Гидролазыкатализируют расщепление внутримолекулярных связей органических веществ при участии молекулы воды.
| СН2 – О – СО – С15Н31 СН2 – ОН ½ липаза ½ СН – О – СО – С15Н31 + 2НОН ---------à СН – О – СО – С15Н31 + 2С15Н31СООН ½ ß-------- ½ пальмитиновая СН2 – О – СО – С15Н31 СН2 – ОН кислота трипальмитин b-пальмитилглицерин |
Фосфатазыгидролизуют фосфорные эфиры:
Г-1-Ф + Н2О 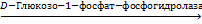 Г + Н3РО4
Г + Н3РО4
Гликозидазыкатализируют гидролиз гликозидов. Амилаза расщепляет гликозидные связи в молекулах крахмала.
Пептидгидролазыускоряют гидролиз пептидных связей в белках и пептидах.
4. Лиазы- ферменты, катализирующие разрыв связей С—О, С—С,
С—N и других, а также обратимые реакции отщепления различных групп от субстратов негидролитическим путем. Эти реакции, как правило, сопровождаются образованием двойной связи и выделением таких простейших продуктов, как СО2, H2O, NH3 и т. д..
Декарбоксилазы относятся к углерод-углерод-лиазам:
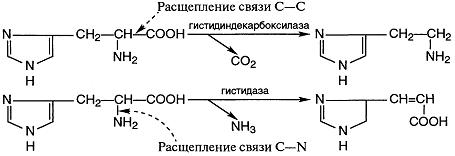
Некоторые лиазы ускоряют реакции не только отщепления, но и присоединения.
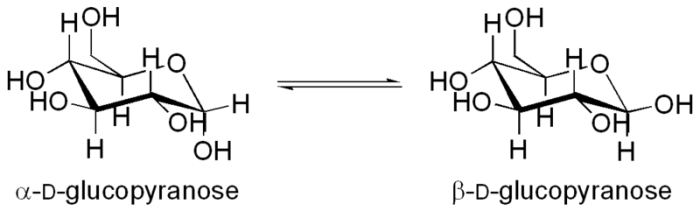
5. Изомеразы- ферменты, катализирующие взаимопревращения структурных, оптических и геометрических изомеров.
Мутаротазаускоряет реакцию превращения α-D-глюкопиранозы в
β-D-глюкопиранозу:
6. Лигазы (синтетазы) - ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии АТФ либо других веществ:
пируваткарбоксилаза
СН3-СО-СООН + СО2 + АТФ ----------------------------àНООС-СН2-СО-СООН + АДФ + Рi.
пировиноградная оксалоацетат
кислота
Международная комиссия подготовила Классификацию ферментов (КФ).Код каждого фермента содержит четыре цифры, разделенные точками. Первая цифра указывает номер класса, вторая означает подкласс и характеризует вид субстрата (у трансфераз указывает на природу переносимой группы, у гидролаз - на тип гидролизуемой связи). Третья цифра уточняет природу участвующих в реакции соединений или групп. Четвертая цифра – номер фермента в данном подподклассе. В подподклассе ферменты располагаются по алфавиту. Пример: каталаза – 1.11.1.6.
ФЕРМЕНТЫ В МЕДИЦИНЕ
Ферменты применяют как лечебные препараты(таблица 2):
- при их отсутствии или недостатке (наследственном или приобретенном);
- для специфического разрушения некоторых продуктов обмена.
Таблица 2. Использование ферментов как лечебных препаратов
| Фермент | Использование |
| Пепсин | Нарушение переваривания белков в желудке |
| Уреаза | Удаление мочевины из организма в аппаратах «искусственная почка» |
| Гиалуронидаза | Рассасывание рубцов |
| Стрептокиназа, урокиназа | Предотвращение тромбообразования при операциях |
Ферменты используют в клинике в качестве аналитических реактивов (таблица 3). Для анализа часто применяются иммобилизованные ферменты, которые искусственно связаны с нерастворимым в воде носителем, что облегчает использование и повышает стабильность ферментов.
Таблица 3. Использование ферментов как аналитических реагентов
| Фермент | Использование |
| Глюкозооксидаза | Определение концентрации глюкозы в крови |
| Липаза | Определение концентрации триацилглицеридов в крови |
| Холестеролоксидаза | Определение холестерина в крови |
Анализ кинетики появления и исчезновения ферментов в сыворотке крови используется в диагностике.
Состав ферментов и их распределение в тканях у взрослого человека в норме в основном постоянны, и могут изменяться при болезнях. Почти все ферменты организма функционируют внутриклеточно. При повреждении тканей внутриклеточные ферменты появляются в сыворотке крови. При воспалительных процессах повышается проницаемость клеточных мембран и в сыворотку крови попадают цитоплазматические ферменты. Некроз ткани сопровождается разрушением всех клеточных структур, и в сыворотке могут быть обнаружены митохондриальные, ядерные и другие ферменты. Такие ферменты называют индикаторными.
Появление в плазме или сыворотке крови ряда тканевых ферментов в повышенных количествах характеризует функциональное состояние различных органов и их поражение (таблица 4).
Таблица 4. Использование ферментов в диагностике
| Заболевание | Фермент |
| Инфаркт миокарда | креатинкиназа, АсАТ, ЛДГ-1 |
| Вирусный гепатит | АлАТ, АсАТ, глутаматдегидрогеназа |
| Заболевания печени | АлАТ, g-глутамилтрансфераза |
| Заболевания поджелудочной железы | a-амилаза |
Энзимопатии (синоним ферментопатии) - общее название болезней, развивающихся вследствие отсутствия или снижения активности тех или иных ферментов. Дефект одного фермента часто приводит к ряду нарушений в обмене веществ вследствие взаимозависимости метаболический процессов в организме.
Выделяют наследственные и приобретенные энзимопатии.
1. Наследственные энзимопатии связаны с генетически обусловленной недостаточностью одного или нескольких ферментов. Известно более 150 наследственных ферментопатий, для которых установлена сущность генной мутации. Ферментативный дефект приводит к накоплению в организме продуктов обмена веществ, нарушающих функцию тех или иных органов, что обусловливает появление клинических признаков болезни. К энзимопатиям относятся фенилкетонурия, гликогенозы, хондродистрофия, гемофилия и т.д.
