Декарбоксилирование аминокислот. Биогенные амины и их обезвреживание.
Реакции по карбоксильной группе
1. Декарбоксилирование аминокислот.Простетической группой декарбоксилаз L-аминокислот служит пиридоксальфосфат (активная форма витамина В6).Продуктами декарбоксилирования аминокислот являются амины. Так как они образуются в качестве продуктов жизнедеятельности и обладают высокой физиологической активностью, их называют биогенными аминами.
Открыты 4 типа декарбоксилирования аминокислот. Для тканей животных характерно α-декарбоксилирование.
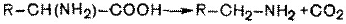
При декарбоксилировании гистидина возникает гистамин. Он вызывает расширение сосудов в очаге воспаления, участвует в секреции соляной кислоты в желудке, что используется в клинике при изучении секреторной деятельности желудка (гистаминовая проба). При повышенной чувствительности к гистамину используют антигистаминные препараты.
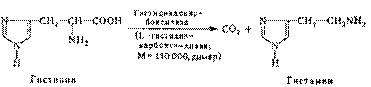
При декарбоксилировании глутаминовой кислоты образуется
g-аминомасляная кислота:
НООСCH(NH2)CH2CH2COOH 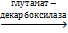 NH2CH2CH2CH2COOH + СО2
NH2CH2CH2CH2COOH + СО2
глутаминовая кислота g-аминомасляная кислота
Она накапливается в мозговой ткани и представляет собой нейрогуморальный ингибитор. ГАМК используется в клинике как лекарственное средство при некоторых заболеваниях ЦНС.
Декарбоксилаза ароматических аминокислот катализирует декарбоксилирование 3,4-диоксифенилаланина (ДОФА), образуется дофамин. Он является предшественником норадреналина и адреналина.
Накопление биогенных аминов может вызывать нарушения ряда функций в организме. Существуют специальные механизмы обезвреживания биогенных аминов. Происходит их окислительное дезаминирование с образованием альдегидов и освобождением аммиака. Ферменты - моноамино-и диаминоксидазы. Локализованы преимущественно в митохондриях. Коферментом является ФАД. Процесс является необратимым и протекает в две стадии:
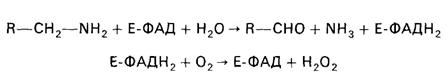
Пероксид водорода далее распадается на воду и кислород.
2. Образование аминоациладенилатов.Эта реакция взаимодействия аминокислоты с АТФ, катализируется ферментами класса лигаз. С аминоациладенилатов аминокислоты передаются на тРНК.
Углеродные скелеты аминокислот могут включаться в ЦТК. Пять аминокислот (фен, лиз, лей, трп, тир) считаются кетогенными, поскольку являются предшественниками кетоновых тел. Большинство других аминокислот называют гликогенными. Они служат в организме источником углеводов. Глюконеогенез усиливается при сахарном диабете, при гиперфункции коркового вещества надпочечников, введении глюкокортикоидов.
96. Источники образования и механизмы обезвреживание аммиака в организме.
Пути связывания аммиака
1. Аспарагиновая и глутаминовая кислотыосуществляют первичное связывание NH3в момент его образования в клетке.Ферменты - аспарагинсинтетазаи глутаминсинтетаза- лигазы. Необходимым условием является участие АТФ.

Синтез глутамина происходит особенно активно в мышцах, мозге, печени. Часть аммиака связывается с a-кетоглутаровой кислотой.
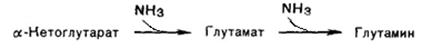
Глутамин и аспарагин выделяются с мочой в небольшом количестве. Предполагают, что они выполняют функцию переноса аммиака в нетоксичной форме. Значительная часть аммиака переносится в печень в виде аланина. Последний образуется из пирувата.
Амидирование аспарагиновой и глутаминовой кислот может происходить и в том случае, если они находятся в составе белковой молекулы. Тем самым обеспечивается немедленное связывание аммиака везде, где он возникает в результате обмена веществ.
2. Мочевина - основной конечный продукт белкового обмена у человека и многих животных. Азот мочевины составляет около 90% всего выводимого азота. Синтез мочевины происходит исключительно в печени, т.к. полный набор ферментов орнитинового цикла есть только в гепатоцитах. Этот процесс протекает в несколько стадий, образующих орнитиновый цикл мочевинообразования Кребса.
Концентрация мочевины в сыворотке крови здоровых взрослых людей составляет 2,5-8,3 ммоль/л (660 мг/л).
3. Некоторое количество аммиака выводится с мочой в виде аммонийных солей.Образование аммиака происходит в почках, главным образом из глутамина:
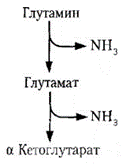
Аммиак акцептирует протон, образуя аммонийную соль. Образование и экскреция аммиака почками представляют собой механизм экскреции протонов (в составе NH4+). Экскреция аммиака с мочой в норме составляет около 0,5 г в сутки. Она повышается при ацидозе (до 20 раз больше нормы). При алкалозе экскреция аммиака отсутствует.
4. Азот выводится в форме креатинина, который образуется из креатина и креатинфосфата, а креатин, в свою очередь – из аминокислот аргинина, глицина и метионина.
5. Часть аммиака используется на биосинтез аминокислот путем восстановительного аминирования a-кетокислот. Это главный путь новообразования аминокислот в организме человека. Даная реакция обратна окислительному дезаминированию аминокислот. Возможно восстановительное аминирование любой кетокислоты. Но активно участвуют в данной реакции a-кетоглутаровая, щавелевоуксусная и пировиноградная кислота:
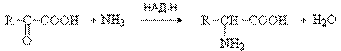
Остальные аминокислоты образуются в результате реакций трансаминирования аспарагиновой и глутаминовой кислот и аланина с соответствующими кетокислотами. Поэтому аланин, аспарагиновую и глутаминовую кислоты называют первичнымиаминокислотами, а все остальные - вторичными.
