Антимикробные, противогрибковые, противовирусные лекарственные средства
АНТИМИКРОБНЫЕ, ПРОТИВОГРИБКОВЫЕ, ПРОТИВОВИРУСНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА
Большое число антимикробных средств существенно увеличивает возможность лечения бактериальных инфекций. Однако до сих пор выбор эффективного и безопасного антибактериального препарата остаётся сложной задачей, что связано с ростом устойчивой бактериальной флоры и зачастую невозможностью выделения возбудителя заболевания, определения его чувствительности к антимикробным ЛС (антибиотикограммы), увеличением числа пожилых людей с хроническими заболеваниями, а также увеличением числа больных с различными иммунодефицитами. Рост числа и травматичности медицинских манипуляций, проводимых с диагностической и лечебной целью, также способствует возникновению и развитию инфекций, вызванных нетипичной флорой и/или необычной её локализацией.
Идеальное противомикробное средство должно обладать избирательной токсичностью. Этот термин подразумевает наличие у препарата повреждающих свойств в отношении возбудителя заболеваний у человека и отсутствие таковых в отношении организма человека. Во многих случаях такая избирательность токсического действия оказывается скорее относительной, чем абсолютной. Это означает, что препарат губительно действует на возбудителя инфекционного процесса в таких концентрациях, которые являются переносимыми для организма человека.
Избирательность токсического действия обычно связана с угнетением биохимических процессов, которые происходят в микроорганизме и являются существенными для него, но не для организма человека. По современным представлениям выделяют следующие главные механизмы противомикробного действия:
• ингибиторы синтеза клеточной стенки (пенициллины, цефалоспорины и другие β-лактамные антибиотики, ристомицин, циклосерин, бацитрацин, ванкомицин, рифампицин) подавляют активность ферментов, участвующих в синтезе пептидогликана, лишая клетку основного каркаса, а также способствуют активации аутолитических процессов. Действуют только на делящиеся клетки;
• ингибиторы синтеза белка в рибосомах (обратимо - макролиды, тетрациклины, линкозамины, хлорамфеникол, фузидовая кислота; необратимо - аминогликозиды);
• препараты, нарушающие метаболизм фолиевой кислоты - рифампицин, сульфаниламиды, триметоприм;
• препараты, нарушающие репликацию ДНК, - ингибиторы ДНКгиразы (хинолоны, фторхинолоны);
• препараты, нарушающие синтез ДНК (нитрофураны, производные хиноксалина, нитроимидазола, 8-оксихинолина).
Современная классификация антимикробных средств по групповой принадлежности и механизму действия представлена в прил. 1.
АНТИБИОТИКИ
β-ЛАКТАМНЫЕ АНТИБИОТИКИ
В группу входят препараты, имеющие в структуре β-лактамное кольцо: природные и полусинтетические пенициллины, цефалоспорины, карбапенемы и монобактамы. С учётом высокой клинической эффективности и низкой токсичности β-лактамные антибиотики составляют основу современной антимикробной терапии, занимая основное место в лечении различных бактериальных инфекций.
Механизм действия β-лактамов заключается в нарушении образования клеточной стенки бактерий за счёт необратимого связывания с пенициллинсвязывающими белками микробной стенки делящихся микроорганизмов. Эти белки по своей природе являются ферментами, обеспечивающими синтез бактериальной клеточной стенки. Нарушение их функции вызывает гибель микробной клетки. В свою очередь одинаковый механизм действия определяет сходные механизмы резистентности, а также целый ряд общих свойств данных препаратов (бактерицидное действие, синергизм с аминогликозидами, низкую токсичность, возможность перекрёстной аллергии у пациентов и т.д.).
С учётом высокой клинической эффективности и низкой токсичности β-лактамы составляют основу современной антимикробной терапии, занимая основное место при лечении различных бактериальных инфекций.
Противопоказания
Заболевания ЖКТ в анамнезе (неспецифический язвенный колит, энтерит или колит, связанный с применением антибиотиков), повышенная чувствительность к линкозамидам или доксорубицину, беременность, грудное вскармливание. При терминальной почечной или печёночной недостаточности необходимо уменьшить дозировку.
Лекарственные взаимодействия
Ингаляционные наркотические средства или миорелаксанты - нервно-мышечная блокада (мышечная слабость, угнетение или остановка дыхания). Для снятия блокады необходимы антихолинэстеразные препараты или кальция хлорид.
Полипептиды
Полипептиды активны по отношению к грамотрицательной флоре (за исключением кокков): P. aeruginosa, E. coli, H. Influenzae, сальмонеллы, шигеллы. Не действуют на большинство штаммов протея, серрации, B. fragilis, возбудителя туберкулёза, дифтерии, на клостридии и грибы. Влияют лишь на внеклеточно расположенных возбудителей.
Полимиксин В (препарат для парентерального введения) - средство резерва для лечения синегнойной инфекции: сепсиса, менингита (вводится интралюмбально), пневмонии, инфекции мочевых путей.
При инфекциях, вызванных другой грамотрицательной микрофлорой, его используют только при полирезистентности возбудителя к другим, менее токсичным препаратам. Не действуют на кокковые аэробные и анаэробные микроорганизмы.
Полимиксин М (препарат для местного применения) используют для терапии кишечных инфекций и местного лечения синегнойных инфекций раневых поверхностей, отита, язв роговицы.
Фармакокинетика
При применении внутрь практически не всасывается. Назначают внутрь при инфекционных энтероколитах и дизентерии, для местного лечения раневых поверхностей.
Полимиксин В при внутримышечном введении всасывается быстро, в крови обнаруживается через 30 мин, максимум его концентрации отмечается через 1-2 ч. При повторных введениях в суточной дозе 2-4 мг/кг средняя концентрация составляет 1-8 мкг/мл. Связь с белком незначительна. Плохо проникает через гистогематические барьеры и ГЭБ, быстро инактивируется в гное. Для создания необходимых концентраций требуется введение непосредственно в очаги инфекции.
Полимиксин В после внутримышечного введения в незначительном количестве выделяется с жёлчью. Метаболизируется в печени. Почками выводится 60% введённой дозы, концентрация его в моче в 20-30 раз превышает плазменную. При сниженной функции почек препарат накапливается в крови.
Нежелательные лекарственные реакции
Нефротоксичность (недопустимо сочетание с другими нефротоксичными препаратами), нейротоксичность, проявления нервно-мышечной блокады (особенно у больных с исходной ХПН, миастенией, на фоне применения миорелаксантов), тромбоцитопения, нарушения электролитного баланса (гипокальциемия, гипокалиемия).
Ристомицин
Фармакокинетика
Не всасывается в ЖКТ, единственный путь введения - внутривенный (внутримышечно не назначают из-за выраженной болезненности). С белками плазмы связывается слабо. Хорошо проникает в лимфу, почки, селезёнку, лёгкие, где его концентрация больше, чем в крови. В меньших концентрациях обнаруживается в печени, миокарде, ткани мозга. При менингитах хорошо проходит через ГЭБ. В плевральных и
перитонеальных экссудатах его концентрация в 2-4 раза ниже, чем в крови. Средняя терапевтическая концентрация (5 ЕД/мл) после однократного вливания в дозе 10 000-20 000 ЕД сохраняется более 6 ч.
Даже при нормальной функции почек может наблюдаться кумуляция препарата. Выводится на 80% почками (в основном в течение первых 3 ч после введения). При почечной недостаточности кратность введения уменьшают. С жёлчью выводится 0,1-0,2%.
Нежелательные лекарственные реакции
При длительном введении отмечаются тромбофлебиты, при попадании под кожу - болезненные инфильтраты. У 5-12% больных наблюдаются лейкопения, нейтропения (вплоть до агранулоцитоза), анемия, токсическая тромбоцитопения, эозинофилия. В связи с этим при необходимости использования препарата в больших дозах, особенно у детей, необходимо один раз в 2 дня делать общий анализ крови. Большинство побочных реакций исчезает через 7-8 дней после отмены препарата. Описано нефро-, гепато- и ототоксическое действие ристомицина, возможно развитие аллергических реакций.
Оксазолиденоны
Оксазолиденоны - новый класс синтетических антимикробных ЛС. В настоящее время в клинической практике применяется один из этих препаратов - линезолид.
Механизм действия оксазолиденонов связан с ингибированием синтеза белка в рибосомах бактериальной клетки. В отличие от других
антибиотиков, ингибирующих синтез белка, они действуют на ранних этапах трансляции (необратимое связывание с 30S- и 50S-субъедини- цей рибосом), вследствие чего нарушаются процесс образования 70S- комплекса и формирование пептидной цепи. В результате уникального механизма действия не отмечается перекрёстной устойчивости микроорганизмов к линезолиду и другим антибиотикам, действующим на рибосомы (макролиды, линкозамиды, стрептограмины, аминогликозиды, тетрациклины и хлорамфеникол).
Проявляет высокую антимикробную активность преимущественно в отношении грамположительных микроорганизмов - стафилококков, энтерококков, пневмококков, различных стептококков (группы А, В, С и viridans), анаэробных кокков, клостридий и некоторых других микроорганизмов. Большая часть грамотрицательных микроорганизмов природно-устойчива к линезолиду. Умеренную активность линезолид проявляет в отношении некотрых грамотрицательных микроорганизмов (минимальная подавляющая концентрация 4 мг/л и выше): M. catarrhalis, H. influenzae, B. pertussis, N. gonorrhoeae, Legionella spp.
Критерии чувствительности грампожительных микроорганизмов к линезолиду:
• энтерококки - чувствительные, промежуточные и устойчивые (соответственно <2, 4 и >8 мг/л);
• стафилококки - чувствительные (<4 мг/л);
• пневмококки - чувствительные (<2 мг/л);
• золотистый и коагулазонегативные стафилококки - чувствительные (1-2 мг/л).
В отношении энтерококков линезолид действует бактериостатически: проявляет стабильную активность в отношении E. faecalis, E. faecium и других энтерококков со значением минимальной подавляющей концентрации 1-4 мг/л, в том числе сохраняет активность в отношении штаммов энтерококков, резистентных к ванкомицину и тейкопланину®.
Линезолид проявляет активность (при одинаковых значениях минимальной подавляющей концентрации) в отношении метициллинчувствительных и метициллинрезистентных стафилококков; в отношении S. aureus и коагулазонегативных стафилококков проявляет бактериостатическое действие.
Активен в отношении как чувствительных штаммов S. pneumoniae, так и штаммов, устойчивых к пенициллину, эритромицину, цефтриаксону, клиндамицину, тетрациклину, хлорамфениколу. В последние годы выделены штаммы S. pneumoniae со сниженной чувствительностью к линезолиду.
В отношении анаэробных бактерий линезолид проявляет бактерицидный эффект: активность в отношении грамположительных анаэробов (C. perfringens, C. difficile) и пептострептококков сравнима с активностью ванкомицина в отношении этих микробов, но в отличие от последнего линезолид действует также на грамотрицательные анаэробы (B. fragilis, Fusobacterim spp., Prevotella spp.).
Линезолид высокоактивен в отношении Bacillis spp. (минимальная подавляющая концентрация 0,5-1 мг/л), Corynobacterium spp. (минимальная подавляющая концентрация 0,25-0,5мг/л), L. monocytogenes (минимальная подавляющая концентрация 0,5-2 мг/л), M. tuberculosis (минимальная подавляющая концентрация 0,5-2 мг/л), Nocardia spp. (минимальная подавляющая концентрация 2-4 мг/л).
In vitro линезолид проявляет слабый постантибиотический эффект. В отношении метициллинрезистентных S. aureus, MSSA и ванкомицинрезистентного постантибиотический эффект составляет при одной минимальной подавляющей концентрации 0,5; 0,3; 0,8; при четырёх минимальных подавляющих концентрациях - 0,6; 1,1; 1,4 соответственно. Постантибиотический эффект in vitro увеличивается при увелечении дозы ЛС и составляет при 20 и 80 мг/кг в отношении пенициллинчувствительных S. pneumoniae 3,6 и 3,8 ч, в отношении MSSA - 3,9 и 3,7 ч соответственно.
Резистентность к линезолиду развивается медленно. Пока частота выделения штаммов микроорганизмов, устойчивых к линезолиду, существенно меньше, чем к ванкомицину и тейкопланину.
Фармакокинетика
При приёме внутрь быстро и хорошо всасывается. Биодоступность составляет около 100%, не зависит от приёма пищи. Максимальные концентрации в крови достигаются через 1-2 ч, распределяется во многих тканях и средах организма. При многократном применении отношение плазменной концентрации к концентрации в бронхиальном секрете и альвеолярной жидкости составляет соответственно 1,0 : 4,5 и 1,0 : 0,15. При однократном применении при отсутствии воспаления мозговых оболочек отношение концентрации линезолида в спинномозговой жидкости к плазменной концентрации составило 0,7:1,0. Связь с белком 31%. Метаболизируется в печени. Экскретируется преимущественно с мочой, в основном в неактивном состоянии. Т1/2 составляет 4,5-5,5 ч, не зависит от возраста пациента и функций печени и почек.
Показания
Эффективность линезолида в контролируемых исследованиях установлена при различных инфекциях, вызванных грамположительны-
ми микроорганизмами (пневмония, инфекции кожи и мягких тканей, мочевыводящих путей, интраабдоминальные инфекции, эндокардит, сепсис). Однако прежде всего его применение показано при инфекциях различной локализации, вызванных мультирезистентными грамположительными бактериями (прежде всего стафилококками и энтерококками).
Сравнительная клиническая эффективность ванкомицина и линезолида одинакова, но линезолид лучше переносится больными. При инфекциях, вызванных мультирезистентными грамположительными и грамотрицательными бактериями, используется комбинация линезолида с цефалоспоринами третьего и четвёртого поколения или фторхинолонами.
АНТИМИКРОБНЫЕ ПРЕПАРАТЫ
Сульфаниламидные препараты
Сульфаниламиды - производные сульфаниловой кислоты, имеют одинаковый спектр действия, основные различия между препаратами определяются особенностью их фармакокинетики.
Парааминобензойная кислота (ПАБК) необходима большинству микроорганизмов для синтеза фолиевой кислоты, которая используется микробной клеткой для образования нуклеиновых кислот. Сульфаниламиды - структурные аналоги-конкуренты ПАБК. Антимикробная активность сульфаниламидов определяется их сродством к рецепторам микробных клеток (т.е. способностью конкурировать за рецепторы с ПАБК). При этом опасности повреждения клеток макроорганизма нет, поскольку в них не происходит синтеза фолиевой кислоты (человек получает её только с пищей). Механизм действия сульфаниламидов объясняет их низкую эффективность в средах с высоким содержанием ПАБК (гной, очаг тканевой деструкции). Большинство микроорганизмов не может утилизироватъ фолиевую кислоту
из окружающей среды, в связи с чем по природной антимикробной активности сульфаниламиды являются препаратами широкого спектра действия. Клиническое применение чаще имеет комбинация с триметопримом. Являясь структурным аналогом птеридиновой части фолиевой кислоты, триметоприм нарушает следующий этап синтеза нуклеиновых кислот - восстановление дигидрофолиевой кислоты в тетрагидрофолиевую (активную форму фолиевой кислоты, ответственную за белковый обмен и деление микробной клетки) и потенцирует действие сульфаниламидов. Таким образом проявляется синергизм между обоими компонентами ко-тримоксазола; эта комбинация обладает бактерицидным действием. Применяют следующие комбинированные препараты триметоприма с сульфаниламидами:
сульфаметоксазол + триметоприм (ко-тримоксазол, бисептол);
сульфаметрол + триметоприм (лидаприм);
сульфамонометоксин + триметоприм (сульфатон).
Соотношение сульфаниламида и триметоприма 5:1. В отличие от сульфаниламидов ко-тримоксазол обеспечивает не только бактериостатический, но и бактерицидный эффект.
Спектр действия сульфаниламидов
Сульфаниламиды имеют широкий спектр антимикробной активности: микроорганизмы (стрептококк, стафилококк, пневмококк, менингококк, гонококк, кишечная палочка, сальмонелла, холерный вибрион, сибиреязвенная палочка, гемофильная палочка), крупные вирусы (возбудители трахомы, пситтакоза, орнитоза, пахового лимфогранулематоза), простейшие (плазмодии малярии, токсоплазмы, патогенные грибы, актиномицеты, кокцидии, гистоплазмы).
Умеренно чувствительны энтерококк, стрептококк зеленящий, клебсиелла, протей, клостридия, пастерелла (в том числе возбудитель туляремии), бруцелла, микобактерия лепры, лейшмани.
Комбинированные препараты (сульфаниламиды + триметоприм) активны в отношении грамположительных и грамотрицательных аэробных кокков: стафилококков (включая некоторые умеренно метициллинрезистентные стафилококки), пневмококков, менингококков, моракселлы, энтеробактерий (E. coli, протеи, шигеллы, сальмонеллы, и другие); H. influenzae (включая некоторые ампициллинустойчивые штаммы), пневмоцист, токсоплазм и ряда других микроорганизмов.
В настоящее время значительно возросло количество штаммов микроорганизмов, устойчивых к сульфаниламидам, что ограничивает их применение. К препаратам данной группы устойчивы энтерококки, синегнойная, коклюшная, дифтерийная палочка, микобактерии туберкулёза, бледные спирохеты, лептоспиры и анаэробы.
Фармакокинетика
Основной путь введения сульфаниламидов пероральный, ко-тримоксазол имеет парентеральные формы для внутривенного и внутримышечного введения; применяются также препараты наружно в виде мазей, глазных капель. При приёме внутрь всасываются в тонком кишечнике, причём скорость и полнота всасывания прямо зависят от липофильности сульфаниламида. Ко-тримоксазол хорошо всасывается при приёме внутрь. Биодоступность - 90-100%. Максимальная концентрация в плазме крови развивается через 2-4 ч.
Не всасываются «утяжелённые» сульфаниламиды - сульфагуанидин (сульгин*), фталилсульфатиазол (фталазол*), оказывающие при приёме внутрь местное антимикробное действие.
Для уменьшения интенсивности ацетилирования сульфаниламидов в ЖКТ их запивают щелочными растворами.
Связь сульфаниламидов с белками определяет длительность их действия. Связь компонентов (триметоприм и сульфаметоксазол) с белками плазмы крови составляет 45% и 66% соответственно. Более существенным фактором, влияющим на время циркуляции препарата в крови, является его способность к реабсорбции в почках. Сульфаниламиды, интенсивно связывающиеся с белками плазмы, могут конкурировать на этом уровне с другими препаратами.
Все сульфаниламиды хорошо проникают в ткани, причём препараты короткого действия проникают быстрее, чем сульфаниламиды пролонгированного действия. Терапевтические концентрации сульфаниламидов обеспечивают бактериостатические концентрации в тканях лёгких, печени, почек. В плевральной, асцитической и синовиальных жидкостях концентрация сульфаниламидов составляет 50-80% от плазменной. Все сульфаниламиды (кроме сульфадиметоксина) хорошо проникают через ГЭБ, создавая в цереброспинальной жидкости терапевтические концентрации. Концентрация препаратов длительного действия в жёлчи продолжительное время выше, чем в плазме.
Метаболизм сульфаниламидов происходит в печени, в меньшей степени в желудке, кишечнике, почках. Основной путь биотрансформации - ацетилирование. Активность ацетилирования сульфаниламидов зависит не только от свойств препарата, но и от генетических особенностей ферментных систем микроорганизма («быстрые» и «медленные» ацетиляторы). Второй путь биотрансформации сульфаниламидов, реализующийся только в печени, - глюкуронизация. Глюкуроновые метаболиты хорошо растворимы в воде, в почках не реабсорбируются. Их антимикробная активность значительно ниже, чем у неметаболизированных сульфаниламидов. Для сульфадиметоксина глюкуронизация - основной путь биотрансформации, в связи с
чем при использовании этого препарата отсутствует опасность развития осложнений, связанных с кристаллурией. У новорождённых этот препарат не может применяться, так как функциональная незрелость глюкуронилтрансферазы приводит к длительной циркуляции и высокой концентрации в крови неметаболизированного препарата, создавая опасность интоксикации.
Сульфаниламиды выводятся из организма с мочой в неизменённом виде либо в виде указанных выше парных эфиров и с жёлчью.
Для лечения инфекции мочевых путей целесообразно назначать сульфаниламиды, выделяющиеся с мочой в активной форме и минимально реабсорбирующиеся, т.е. препараты короткого действия. При ощелачивании мочи увеличивается ионизация сульфаниламидов, растворимость в воде, снижается реабсорбция, что уменьшает вероятность кристаллурии и способствует поддержанию в моче высоких концентраций сульфаниламидов.
Для обеспечения стойкой щелочной реакции мочи рекомендуется ощелачивающее питьё (достаточно назначения соды по 5-10 г/сут), для улучшения растворимости метаболитов сульфаниламидов лечение ими следует проводить на фоне повышенной водной нагрузки.
Нецелесообразно во время лечения употреблять кислые продукты питания (лимон, клюквенный сок). Особенно существенны эти рекомендации при использовании сульфаниламидов, образующих большое количество плохо растворимых ацетилированных метаболитов (сульфаниламид, сульфадимезин, сульфаметоксипиридазин, сульфамонометоксин).
При нарушении выделительной функции почек замедляется экскреция метаболизированных и активных фракций сульфаниламидов, что увеличивает опасность развития токсических эффектов. При умеренных проявлениях почечной недостаточности следует уменьшать суточные дозы препаратов и увеличивать интервалы между приёмами.
Нежелательные лекарственные реакции
Могут наблюдаться диспепсические явления (тошнота, рвота) и диарея. Реже отмечаются гематотоксичность (гемолитическая анемия, тромбоцитопения), гепатотоксичность. Особенно часто (45-65% случаев) сыпь и лейкопения отмечаются у пациентов со СПИДом. Высок риск аллергических реакций, развития синдромов Лайелла и Стивен- са-Джонсона. Вероятность токсических и аллергических осложнений применения сульфаниламидов значительно увеличивается при снижении фильтрационной функции почек.
Одно из наиболее опасных осложнений терапии сульфаниламидами - кристаллизация ацетилированных метаболитов в почках и моче-
выводящих путях. У новорождённых и грудных детей сульфаниламиды могут вызывать метгемоглобинемию за счёт окисления фетального гемоглобина. Опасно использование сульфаниламидов при гипербилирубинемии, поскольку они, вытесняя билирубин из связи с белками, могут способствовать реализации его токсического действия.
При использовании ко-тримоксазола может развиваться картина недостаточности фолиевой кислоты (нарушение кроветворения, гипотрофия, поражения ЖКТ). Для лечения этих осложнений может применяться фолиевая кислота.
Показания
• Пневмоцистная пневмония у больных со СПИДом (лечение и профилактика).
• Инфекции мочевыводящих путей (острый цистит, хронический рецидивирующий цистит, пиелонефрит, нетяжёлые стафилококковые инфекции).
• Нокардиоз, токсоплазмоз, бруцеллёз.
Препараты данной группы могут применяться при кишечных инфекциях: шигеллёзе, сальмонеллёзе, диарее путешественников, однако большинство шигелл и сальмонелл резистентно к ко-тримоксазолу.
Противопоказания
Сульфаниламиды не следует назначать при аллергии на сульфаниламидные препараты, фуросемид, тиазидовые диуретики, ингибиторы карбоангидразы, препараты сульфонилмочевины. Не применяется при беременности (особенно в I и III триместрах), у детей до 2 мес. Конкуренция сульфаметоксазола с билирубином за связывание с белками плазмы и высокие концентрации свободного сульфаметоксазола повышают риск развития ядерной желтухи у новорождённых. Проникая в грудное молоко, сульфаметоксазол может вызвать ядерную желтуху у детей, находящихся на грудном вскармливании, а также гемолитическую анемию у детей с дефицитом глюкозо-6-фосфатдегидрогеназы. Триметоприм нарушает метаболизм фолиевой кислоты. Допустимо применение ко-тримоксазола у детей с 4-6-недельного возраста, родившихся у ВИЧ-инфицированных матерей.
Противопоказаны при тяжёлой почечной недостаточности (ко-тримоксазол не следует применять при CL креатинина <20 мл/мин), при тяжёлых нарушениях функции печени. Не применяются при мегалобластической анемии, связанной с дефицитом фолиевой кислоты.
Взаимодействия с другими препаратами
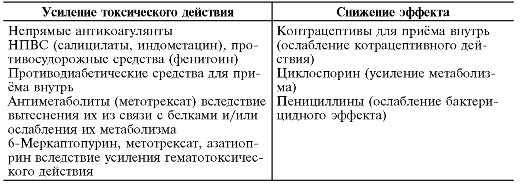
Лекарственные взаимодействия представлены в табл. 26-18.
Таблица 26-18.Лекарственные взаимодействия ко-тримоксазола
 При хронических воспалительных заболеваниях кишечника (неспецифический язвенный колит, болезнь Крона и др.) эффективна комбинация сульфаниламидов длительного действия с производными аминосалициловой кислоты - месалазином, салазодиметоксином*. Эти препараты, практически не всасываясь, расщепляются в просвете толстого кишечника до сульфаниламидов, обеспечивающих антимикробное действие, и остатка аминосалициловой кислоты, оказывающей противовоспалительный эффект.
При хронических воспалительных заболеваниях кишечника (неспецифический язвенный колит, болезнь Крона и др.) эффективна комбинация сульфаниламидов длительного действия с производными аминосалициловой кислоты - месалазином, салазодиметоксином*. Эти препараты, практически не всасываясь, расщепляются в просвете толстого кишечника до сульфаниламидов, обеспечивающих антимикробное действие, и остатка аминосалициловой кислоты, оказывающей противовоспалительный эффект.
Снижают эффективность сульфаниламидов препараты, в процессе метаболизма которых образуется ПАБК (бензокаин , прокаин, прокаинамид). Антагонистом ко-тримоксазола является фолиевая кислота. Нецелесообразно также на фоне лечения сульфаниламидами употреблять пищевые продукты, содержащие в больших количествах ПАБК, - зелё- ные части растений (цветная капуста, шпинат, морковь, помидоры, бобовые).
Нитрофураны
Нитрофураны оказывают преимущественно бактериостатический эффект, устойчивость к ним развивается медленно. Спектр антимикробного действия довольно широк: нитрофураны подавляют грамположительные (стрептококки, пенициллиназопродуцирующие стафилококки), грамотрицательные микроорганизмы (кишечные палочки, сальмонеллы, шигеллы, клебсиеллы, энтеробактеры) и многие простейшие (лямблии, трихомонады). Антимикробное действие не снижается в присутствии гноя и других продуктов тканевого распада. По спектру действия, фармакокинетическим характеристикам представители этой группы препаратов существенно отличаются друг от друга.
Нитрофурал (фурацилин*)в связи с производством более безопасных и эффективных нитрофуранов применяется только местно (полоскание зева, промывание раневых поверхностей, при лечении гнойных ран), в настоящее время к нему устойчивы возбудители многих внутрибольничных инфекций.
Нитрофурантоин (фурадонин*)хорошо всасывается, его используют только при инфекциях мочевыводящих путей, что обусловлено осо-
бенностями его фармакокинетики: он чрезвычайно быстро выводится почками (Т1/2составляет 20-60 мин) и в крови и тканях не создаётся средней терапевтической концентрации. Антимикробный эффект усиливается в щелочной моче. Нитрофурантоин значительно токсичнее других нитрофуранов, назначаемых внутрь. Вероятность токсических эффектов препарата повышается при нарушении выделительной функции почек (при снижении CL креатинина ниже 40 мл/мин препарат не назначают) и при сочетании с подкисляющими мочу препаратами.
Фуралтадон (фуразолин*)по спектру антимикробной активности мало отличается от фуразолидона, лучше всасывается, менее активен по отношению к простейшим. Средняя терапевтическая концентрация после приёма разовой дозы удерживается в течение 4-6 ч. При кислой реакции мочи усиливается реабсорбция препарата, что может привести к кумуляции. При низких значениях рН и олигурии препарат отменяют.
Нифурател (макмирор*)оказывает противопротозойное, противогрибковое действие. Обладает широким спектром антимикробного действия, активен в отношении Trichomonas vaginalis, высокоактивен в отношении рода Candida. Применяется для лечения вульвовагинальных инфекций, инфекционно-воспалительных заболеваний мочевыводящих путей, кишечного амёбиаза и лямблиоза. Возможны аллергические реакции и диспепсические явления. Противопоказан при беременности и лактации.
Нифуроксазид (эрсефурил*)- противомикробное средство широкого спектра действия (грамположительные возбудители: стафилококки, стрептококки, гемофильная палочка; грамотрицательные микроорганизмы: сальмонеллы, энтеробактер). Кишечная палочка, протей. Не нарушает равновесия кишечной микрофлоры. Имеет низкую абсорбцию, поэтому применяется при диарее инфекционного генеза. Противопоказано применение при гиперчувствительности к препарату и нитрофуранам, у новорождённых.
Фуразидин (фурагин*).Основная особенность фармакокинетики - относительно медленное выведение, поэтому может назначаться два раза в сутки; в моче отмечаются более низкие концентрации препарата, чем на фоне нитрофурантоина.
Растворимый фуразидин применяется внутривенно капельно, введение суточной дозы (0,1% водный раствор) обеспечивает среднюю терапевтическую концентрацию в крови и тканях в течение 48 ч.
Фуразолидонподавляет развитие трихомонад и лямблий, грамположительных и грамотрицательных микроорганизмов. Блокирует МАО. Назначают внутрь (после еды). Всасывается хуже, чем нитрофурантоин и фурагин*, терапевтическая концентрация его сохраняется в кро-
ви 4-6 ч. В терапевтических концентрациях обнаруживается в жёлчи, моче. Выделяясь с жёлчью, оказывает хороший эффект при кишечных инфекциях. Особенно активен по отношению к возбудителям дизентерии, брюшного тифа и паратифов, лямблиозе. Основной путь элиминации - почечная экскреция. Кумулирует в крови при выраженных нарушениях клубочковой фильтрации.
Лекарственные взаимодействия
Опасно сочетание нитрофуранов с кислыми препаратами (витамин С, кальция хлорид, аммония хлорид).
В связи со способностью фуразолидона ингибировать МАО противопоказано сочетание его с другими препаратами, ингибирующими этот фермент (ниаламид и др.), сочетание фуразолидона с этими препаратами может вызвать артериальную гипертензию за счёт увеличения активности эндогенных катехоламинов.
Нежелательные лекарственные реакции
Диапазон между терапевтическими и токсическими дозами нитрофуранов довольно велик. Побочные реакции при использовании фуразолидона, фурагина*, фуразолина* встречаются реже и примерно с одинаковой частотой. Значительно возрастает вероятность токсических осложнений у новорождённых и при почечной недостаточности.
Наиболее часто встречаются диспепсические расстройства (тошнота, рвота, боль в животе), которые особенно характерны для нитрофурантоина. Для профилактики диспепсических расстройств нитрофураны принимают после еды, запивают щелочными растворами. Значительно реже встречаются неврологические (моно- и полиневриты) и гематологические (гемолитическая и мегалобластная анемии) осложнения, поражение кожи (лейкодерма) и бронхолёгочные проявления побочного действия (отёк лёгких, бронхоспазм, пневмонит у женщин старше 60 лет, сопровождающийся лихорадкой и эозинофилией). У новорождённых и грудных детей возможно образование метгемоглобина. Аллергические реакции при использовании нитрофуранов встречаются редко, в основном ограничиваются поражением кожи.
Весьма специфическим свойством нитрофуранов, имеющим практическое значение, является их способность снижать толерантность к алкоголю (антабусоподобный эффект). Эффект сохраняется в течение 5-7 дней после отмены нитрофуранов.
Оксихинолины
Нитроксолин.Бактерицидное действие препарата реализуется путём комплексирования их с ионами металлов, необходимых для актива-
ции ферментных систем микроорганизмов. Действует бактерицидно. Селективно ингибирут синтез бактериальной ДНК. Спектр действия включает грамотрицательные бактерии, амёбы, грибы рода Candida.
Нитроксолин хорошо всасывается в ЖКТ. Очень быстро выводится почками, что обусловливает низкую плазменную концентрацию (при сохранённой функции почек). Показанием к назначению нитроксолина являются инфекции мочевыводящих путей, вызванные грамотрицательной микрофлорой. Нитроксолин можно сочетать с противогрибковыми антибиотиками и сульфаниламидами. Не используют у новорождённых и больных со сниженной функцией почек.
Применяется для лечения дизентерии, сальмонеллёза, пищевых токсикоинфекций, вызванных стафилококками и энтеробактериями, энтероколите, дисбактериозе; вагините, трихомониазе.
Нитроимидазолы
Группа нитроимидазолов представлена следующими синтетическими препаратами: метронидазолом, тинидазолом, орнидазолом.
Фармакодинамика
Нитроимидазолы избирательно воздействуют на микроорганизмы, ферментные системы которых способны восстанавливать нитрогруппу. Активные восстановленные формы препаратов нарушают репликацию ДНК и синтез белка в микробной клетке, ингибируют тканевое дыхание.
Спектр активности
Препараты обладают высокой активностью в отношении анаэробных бактерий и простейших. К нитроимидазолам чувствительны T. vaginalis, E. histolytica, G. lamblia, L. intestinalis, B. coli, Leishmania spp., а также H. pylori.
Фармакокинетика
Хорошо всасываются при приёме внутрь. Биодоступность метронидазола более 80%, орнидазола - 90%, тинидазола - 100% и не зависит от приёма пищи. После ректального введения метронидазола в свечах биодоступность на 10% ниже, чем при приёме внутрь.
Метронидазол.При внутривенном введении 500 мг в течение 20 мин максимальная концентрация в сыворотке крови через 1 ч составляет 35,2 мкг/мл, через 4 ч - 33,9 мкг/мл, через 8 ч - 25,7 мкг/мл. Время достижения максимальной концентрации - 30-60 мин, минимальная концентрация при последующем введении 18 мкг/мл. Максимальная концентрация определяется через 1 ч после прекращения введения
и поддерживается на терапевтическом уровне в крови 6-8 ч. Объём распределения у взрослых 0,54-0,81 л/кг. Связь с белком плазмы 10-
20%.
Тинидазол.Максимальная концентрация после приёма наблюдается через 2 ч, составляет 40-50 мкг/мл, через 24 ч - 11-19 мкг/мл, через 72 ч - 1 мкг/мл, объём распределения 50 л, связь с белком -
12%.
Орнидазол.Время достижения максимальной концентрации - 1- 2 ч, связь с белками плазмы не менее 15%.
Метаболизм
Нитроимидазолы метаболизируются в печени с образованием активных и неактивных метаболитов (метронидазол метаболизируется на 30-60% с образованием активного метаболита 2-оксиметронидазо- ла, оказывающего противопротозойное и антимикробное действие).
Распределение
Хорошо распределяются, проникают в ткани, абсцессы, через ГЭБ, плаценту; проникают в грудное молоко, выделяются со слюной и желудочным соком.
Выведение
Метронидазол. Т1/2 - 8-12 ч, при алкогольном поражении печени - 10-29 ч. Выводятся из организма почками 60-80% принятой дозы, примерно 20% в неизменённом виде; экскреция с жёлчью 50%, причём концентрация препарата в жёлчи может превышать концентрацию в крови, в кишечнике вновь всасывается; при дефекации выводится до 6-15%. При повторных введениях возможна кумуляция. При выраженной почечной недостаточности (CL креатинина <10 мл/мин) суточная доза должна быть уменьшена вдвое. Метронидазол и основные метаболиты быстро удаляются из крови при гемодиализе (ТНаши рекомендации
