Ферменты. Простые и сложные ферменты.
Ферменты. Простые и сложные ферменты.
Ферменты – белки, выполняющие специфическаие функции катализа химическийхреакции. Ферменты имеют уникальные свойства: они представляют самые эффективные катализаторы в природе. Есть две важные характеристики фермента: во-первых, фермент не изменяется, вступая в реакцию, и выходит из реакции в первоначальном состоянии; во-вторых, фермент не изменяет положения равновесия реакции, он лишь ускоряет течение химической реакции (достижение равновесия). Таким образом, фермент ускоряет реакцию без изменения термодинамических свойств системы, с которой он взаимодействует. У простых ферментов (однокомпонентных, т.е. состоящих только из полипептидных цепей) ряд функциональных групп определённых аминокислот формирует активный центр молекулы, который обеспечивает непосредственное взаимодействие её с субстратами. У сложных ферментов различают апофермент, или белковую часть молекулы, которая в свободном виде не обладает ферментативной активностью, и небелковый компонент – кофермент (кофактор), или простетическую группу, который определяет активность молекулы фермента. Соединение апофермента и небелкового компонента осуществляется в основном за счёт водородных, ионных связей. Обычно связь между коферментами и белком слабее, чем свзяь между простетической группой и белком. В ферментативной реакции кофермент проявляет относительную самостоятельность. Небелковая часть двухкомпонентных ферментов выступает как акцептор, или как донор атомов, функциональных групп. Она является составной частью активных центров сложных ферментов. Небелковый компонент осуществляет контакт между апоферментом и субстратом, непосредственно участвуя в катализе. Коферменты могут быть представлены органическими веществами (нуклеотиды, витамины) или неорганическими веществами (металлы). В частности, важную роль в биохимических процессах играет кофермент А (HS-КоА). Его структура включает адениловый нуклеотид, соединённый с пантотеновой кислотой, которая связана, в свою очередь, с b-аминоэтантиолом. Помимо активных каталитических центров, многие сложные ферменты имеют и регуляторные, или аллостерические, центры. Такие ферменты получили название аллостерических. Аллостерические ферменты являются олигомерами, а значит, они состоят из нескольких отдельных белковых мономеров (протомеров).
Свойства ферментов.
Ферменты обладают всеми свойствами, присущими катализаторам: специфичность действия, зависимость от рН и температуры среды, активность в чрезвычайно малых концентрациях. Большинство известных ферментов является высоко специфическими катализаторами. Специфичность действия ферментов рассматривается как способность катализировать определённый тип химической реакции и как способность их взаимодействовать с определённым субстратом или группой субстратов, схожих по химической структуре. Некоторые ферменты имеют абсолютную субстратную специфичность, когда фермент действует на единственный субстрат Большое число ферментов обладает относительной или групповой специфичностью. Выраженной характеристикой ферментов является их стереохимическая специфичность. Это означает, что фермент оказывает своё влияние лишь на определённый оптический антипод субстрата. Ферменты различают субстрат-изомеры, они способны выявлять различия между двумя равноценными атомами и симметричной молекуле субстрата. Фермент способен катализировать Ферменты различают субстрат-изомеры, они также способны выявлять различия между двумя разноцветными атомами и симметричной молекуле субстрата. Фермент способен катализировать только одну специфическую конфигурацию симметричной молекулы, а поэтому только один продукт. Скорость ферментативной реакции зависит от температуры среды. Раствор фермента при нагревании при определенной температуре теряет необратимо свои свойства (термолабильность). Оптимальная скорость ферментативной реакции для большинства ферментов наблюдается при 40-45оС. Дальнейшее повышение температуры приводит к резкому снижению скорости реакции вплоть до полного прекращения реакции при температурной инактивации фермента. Инактивирование фермента сопровождается процессом денатурации белковых молекул. В сухом состоянии чувствительность фермента к температурному режиму менее выражена. Понижение температуры ниже температурного оптиума снижает, затем полностью останавливает активность фермента, но этот феномен остается обратимым. Концентрация в среде водородных ионов является важным фактором, определяющим активность фермента. Это необходимо для ионизации функциональных групп активного центра фермента, вероятно, что только в определенном состоянии ионизации фермент будет наиболее активен. Каждый фермент оптимально функционирует только при определенной величине рН, называемой рН-оптимумом. Оптимум рН для большинства ферментов близок к нейтральным значениям. Изменения величины рН могут приводить к нестабильности белка (фермента) в растворе, что резко меняет его натуральные свойства. У сложных ферментов изменение концентрации водородных ионов сказывается и на степени диссоциации кофермента и апофермента, составляющих единый комплекс, что может привести к инактивации ферментов.
Гидролазы.
Это группа ферментов, катализирующих гидролитическое расщепление субстрата с введение элементов воды на уровне его специфической связи. Примером действия гидролитических ферментов является расщепление пептидных связей между различными аминокислотными остатками в белках рядом пептидаз. Часто р-и этого типа носят необратимый характер. К классу гидролаз относят эстеразы, фосфоэстеразы, карбоксиэстеразы, гликозидазы, пептидазы, амидазы, полифосфатазы, многие ферменты пищеварительных соков (амилаза, пепсин, трипсин). Также гидролазы есть в лизосомах, субклеточных структурах.
Оксидоредуктазы.
Это ферменты, катализирующие р-и окисления и восстановления, т.е. перенос электронов от донора к акцептору. Окисление представляет собой отнятие атомов водорода (электронов) от субстрата, тогда как восстановление – присоединение атомов водорода к акцептору . к оксидоредуктазам относятся : дегидрогеназы, оксидазы, оксигеназы, гидроксилазы, пероксидазы, каталазы. Пример :фермент гликоль : НАД+-дегидрогеназа катализирует р-ю превращения спирта в альдегид. Оксидоредуктазы, переносящие атом водорода или электроны непосредственно на атомы кислорода, называются аэробными дегидрогеназами (оксидазами), тогда как переносящие атом водорода или электроны от одного компонента дыхательной цеп и ферментов к другому – анаэробными. Они являются двухкомпонентными ферментами, у кот.один и тот же кофермент может связываться с различными апоферментами. В конце многочисленного класса оксидоредуктаз находятся ферменты типа каталаз и пероксидаз. Из всего кол-ва белков пероксисом клеток до 40% приходится на каталазу.
Трансферазы.
Это многочисленный класс ферментов, катализирующих перенос функциональной группы, исключая водород, с одной молекулы на другую. Пример: аминотрансферазы (трансаминазы) переносят аминогруппу АК на кетокислоту, в рез-те чего образуется новая АК и новая кетокислота. Трансферазы – сложные ферменты, роль кофермента у многих из них выполняет производое витамина В6.
Лиазы и лигазы.
Лиазы – ферменты, кот.расщепляют внутримолекулярные сязи в молекулах субстратов негидролитическим путем и удаляют СО2, NH3 или Н2О с образованием в-в с двойными связями. Пример: цитратдегидрогеназа превращает лимонну к-ту в цис-аконитовую. Все лиазы классифицируются по типу расщепляемых связей на углерод – углерод – лиазы (подкласс 1), углерод – кислород лиазы ( подкласс 2), углерод – азот – лиазы (подкласс 3), углерод – сера лиазы (подкласс 4), углерод – галоид – лиазы (подкласс 5).
Лигазы (синтетазы) – ферменты, обеспецивающие р-и синтеза в-ва (образования новых связей) из 2х веществ с затратой энергии АТФ. Эти ферменты классифицируются по типу образуемых связей: подкласс 1 – образование С-О связей, подкласс 2 – образование С-S связей, подкласс 3 – образование С-N связей, подкласс 4 0 образование С-С связей.
Изомеразы и синтетазы
Изомеразы (синтетазы) — имеют разное строение при одинаковой структурной формуле.Это очень разнородный клас ферментов, который катализирует реакц внутримолекулярной изомеризации нескольких типов. Например, к подклассу 1 (рацемазы и эпимеразы) относиться фермент лактатрацемаза (КФ 5.1.2.1):D-молочая кислота + изомераза = L-молочная кислота
Под влиянием изомераз осуществляются реакции взаимопревращений цис-транс-изомеров (подкласс 2), например, малеината в фумарат (под действие малеинат-цис-транс-изомеразы — КФ 5,2,1,1). Некоторые ферменты из класса изомераз можно рассматривать также как внутрималекулярные оксидоредуктазы (подкласс 3), внутримолекулярные трансферазы (подкласс 4),внутримолекулярные лиазы (подкласс 5).
Изоферменты
Изоферменты. «Изо» - равный.Катализируют одну и ту же реакцию, но лакализованы в разных тканя. Имеют отличия в структуре малекулы, малекулярной массе. Поэтому при электрофарезе изоформы двигаються с разной скоростью и образуют на осителе ( после окраски) зоны индивидуальной формы.Лактатдегидрогиназа (ЛДГ) — катализирует р-ию превращения молочной кислоты. Она имеет четвертичную структуру, образованную 4-мя субъединицами 2-х типов:Н — сердце, М — мышца.За счет сочетания этих двух типов ЛДГ имеет 5-ть изоформ, локализованых в разных органах.
ЛДГ1 НННН Н4 — присутствует в сердечной мышце — самая быстрая.
ЛДГ2 НННМ Н3М
ЛДГ3 ННММ Н2М2
ЛДГ4 НМММ Н1М3
ЛДГ5 ММММ М4 — самая мдленная, для мышечной ткани.
При получении изоферментного спектра ЛДГ, его сравнивают с нормой здорового пациента.При заболевании органа присутствует в форме характерной для данного органа и концентрация его увеличиваеться. Кроме качественой оценки, производят количественную, методом деситометрии.
Классификация витаминов
Классификация витаминов. Водорастворимые В(1,2,3,5,6,с,12),С,Н,Р; Жирорастворимые А,D,Е,К,F. Витаминоподобные — F, U и др. Жирорастворимые образуються в организме, синтезируються и депонируються в печени, для их всасывания нужны жиры. Водорастворимые не образуються в организме, должны присутствовать в рационе.
Аэробный распад углеводов.
Цикл Кребса, цикл трикарбоновых кислот, цикл лимонной к-ты.
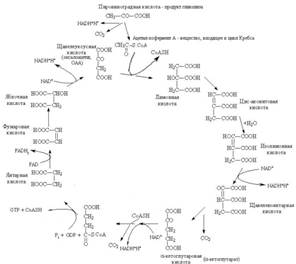
GDF- ГДФ гуанозиндифосфат.
Окисление жирных кислот.
Окисление глицерина.
СН2ОН СН2ОН Н-С=О
НС-ОН+АТФ= НС-ОН +НАД+ = СНОН
СН2ОН СН2-О-Р СН2-О-Р
глицерин фосфоглицерин
Глицерин может служить источником энергии, окисляясь до углекислоты и воды. На 1 этапе глицерин переходит в активную форму фосфоглицерин. Получившийся в конце фосфоглицериновый альдегид, который участвует в анаэробном и аэробным гликолизе, глюконеогенезе.
Биосинтез жирных кислот.
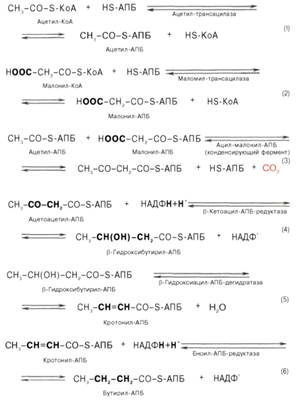 Синтез жир.к-т имеет место во всех органах и тканях, но более активнее проходит в печение, легких, мол.железе, мозге.
Синтез жир.к-т имеет место во всех органах и тканях, но более активнее проходит в печение, легких, мол.железе, мозге.
АПБ- ацетилпереносящий белок
7) Если организму нужна масляная к-та, то эти реакции заканчиваются.
+НОН = СН-СН-СН-СН -СООН +HSАПБ (масляная к-та)
Если организму нужны высокомолекулярные жир.к-т, тогда масляная взаимодействует опять с молонином SАПБ.
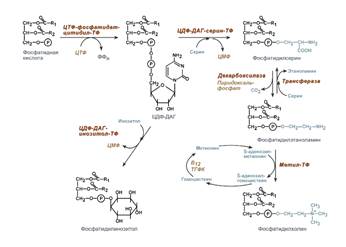
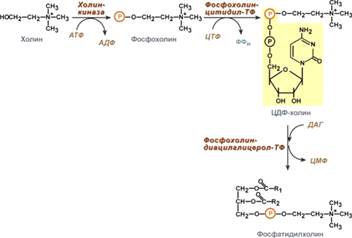
Синтез фосфолипидов.
Во всех органах, тканях, кроме эритроцитов.
1) Если есть готовый холин. 2) Если нет готового холина:
Синтез гемоглобина.
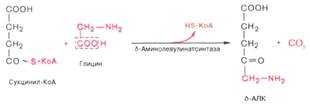 1)
1)
АЛК- аминолевуленовая к-та
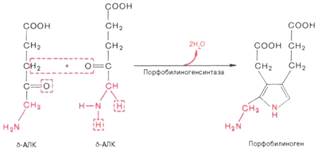 2)
2)
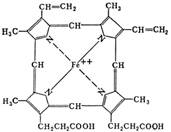 Конденсация 4 молекул порфобилиногена приводит в получению структуры протопорфирина, при включении в которую атома железа образуется гем. Он связывается с белком глобином, образуя молекулу гемоглобина.
Конденсация 4 молекул порфобилиногена приводит в получению структуры протопорфирина, при включении в которую атома железа образуется гем. Он связывается с белком глобином, образуя молекулу гемоглобина.
Ферменты. Простые и сложные ферменты.
Ферменты – белки, выполняющие специфическаие функции катализа химическийхреакции. Ферменты имеют уникальные свойства: они представляют самые эффективные катализаторы в природе. Есть две важные характеристики фермента: во-первых, фермент не изменяется, вступая в реакцию, и выходит из реакции в первоначальном состоянии; во-вторых, фермент не изменяет положения равновесия реакции, он лишь ускоряет течение химической реакции (достижение равновесия). Таким образом, фермент ускоряет реакцию без изменения термодинамических свойств системы, с которой он взаимодействует. У простых ферментов (однокомпонентных, т.е. состоящих только из полипептидных цепей) ряд функциональных групп определённых аминокислот формирует активный центр молекулы, который обеспечивает непосредственное взаимодействие её с субстратами. У сложных ферментов различают апофермент, или белковую часть молекулы, которая в свободном виде не обладает ферментативной активностью, и небелковый компонент – кофермент (кофактор), или простетическую группу, который определяет активность молекулы фермента. Соединение апофермента и небелкового компонента осуществляется в основном за счёт водородных, ионных связей. Обычно связь между коферментами и белком слабее, чем свзяь между простетической группой и белком. В ферментативной реакции кофермент проявляет относительную самостоятельность. Небелковая часть двухкомпонентных ферментов выступает как акцептор, или как донор атомов, функциональных групп. Она является составной частью активных центров сложных ферментов. Небелковый компонент осуществляет контакт между апоферментом и субстратом, непосредственно участвуя в катализе. Коферменты могут быть представлены органическими веществами (нуклеотиды, витамины) или неорганическими веществами (металлы). В частности, важную роль в биохимических процессах играет кофермент А (HS-КоА). Его структура включает адениловый нуклеотид, соединённый с пантотеновой кислотой, которая связана, в свою очередь, с b-аминоэтантиолом. Помимо активных каталитических центров, многие сложные ферменты имеют и регуляторные, или аллостерические, центры. Такие ферменты получили название аллостерических. Аллостерические ферменты являются олигомерами, а значит, они состоят из нескольких отдельных белковых мономеров (протомеров).
