Глава iv трансфузионная терапия острых заболевании органов брюшной полости
Острые заболевания брюшной полости, как правило, требуют неотложной хирургической помощи, и лишь некоторые из них могут быть излечены с помощью консервативной терапии. Панкреатит, перитонит и кишечная непроходимость развиваются подчас так стремительно, что в течение нескольких часов способны вызвать грубые' расстройства гомеостаза, ставящие организм на грань жизни и смерти. Даже после устранения первопричины острого живота возникшие нарушения могут прогрессировать. Иногда при таких состояниях трансфузионная терапия становится средством реанимации. Своевременная и рациональная коррекция нарушений внутренней среды организма часто играет такую же роль, как и хирургическое вмешательство. Успех этого лечения во многом зависит от правильного понимания патогенеза заболевания, четкого распознавания клинических фаз его развития и механизма действия трансфузионных средств.
ПЕРИТОНИТ
Несмотря на значительные успехи современной хирургии, перитонит все еще остается сравнительно частым и весьма опасным осложнением, возникающим при ряде заболеваний или состояний. Летальность при перитоните, по данным ряда авторов [СавельевВ. С., 1970-МаятВ.С., Федоров В. Д„ 1970; Симонян К. С., 1971^ Шалимов А. А. и др., 1970; Федоров В. Д., 1974; Кузин М. И. и др., 1977; Norton В. et al„ 1975], колеблется от 10 до 50%, а в пожилом и старческом возрасте достигает 70% [Дядичкин В. П., 1977].
В последние годы лечение перитонита превратилось из чисто хирургической проблемы в предмет особого внимания реаниматологов. Этому в значительной мере способствовали достижения современной диагностики, позволившие проводить постоянный контроль за состоянием больного с помощью следящей аппаратуры и в любое время получать необходимые данные о сдвигах, происходящих в водно-солевом обмене или кислотно-щелочном состоянии, в центральной или периферической гемодинамике и др.
Патогенез. Развитие перитонита связано с проникновением в брюшную полость различных патогенных микробов или химических агентов при заболеваниях желудочно-кишечного тракта или в результате механической травмы живота с повреждением полых органов. Очень быстро развивающееся воспаление брюшинного покрова вызывает патофизиологические сдвиги и проявляется определенным клиническим синдромом.
Первостепенную роль при этом играют нарушения функций вегетативной нервной системы. Прежде всего следует отметить нарушения нейроэндокринной регуляции, а также нейрогу-морального равновесия (схема 5). В связи с повышением активности симпатико-адреналовой системы в крови больного увеличивается содержание катехоламинов (адреналин, норадреналин), что, как правило, сопровождается угнетением холинергических реакций. Результатом этих расстройств, в том числе угнетения функций блуждающего нерва, а также чревных нервов, является торможение перистальтики кишечника. Тормозное действие, оказываемое на гладкую мускулатуру кишечника, вызывает спазм мезентериальных сосудов и снижение в них кровотока [Гальперин Ю.М., 1975].
Схема 5
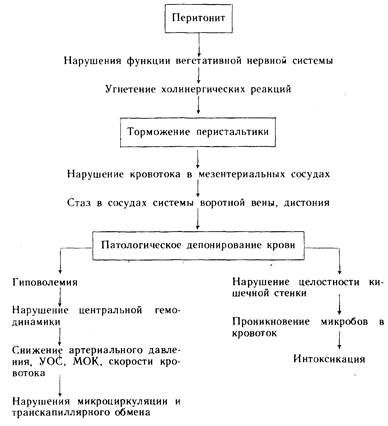
Нарушение кровообращения в стенке кишечника является важным звеном в развитии тяжелых осложнений, связанных с перитонитом. При ухудшении циркуляции в капиллярах кишечной стенки возникает стаз в венозных сосудах с повышением кровяного давления в воротной вене. Нарушения циркуляции крови вызывают дистрофические явления, усиливающие проявления перитонита -
Потеря кишечной стенкой барьерной функции обусловливает развитие общей интоксикации организма и проникновение микробов в кровоток. Процесс из местного быстро становится общим.
Развивающаяся дистония сосудов брюшной полости, в которых скапливается значительная часть циркулирующей крови, обусловливает патологическое депонирование в системе воротной вены, что влечет за собой гиповоле-мию и нарушение центральной гемодинамики.
По данным ряда авторов [Симонян К. С., 1971;
Маломан Е. И. и др., 1976; Бугуляк В. В., 1974; Ду-денко Ф. И., 1974], дефицит ОЦК при остром разлитом перитоните может достигать 1,5л, причем в основном за счет плазменного компонента (ОЦП). Снижение ОЦП связано не только с патологическим депонированием крови в портальной системе и других емкостных сосудах, но и с большими нарушениями обмена жидкости в организме больного.
Гиповолемия, возникшая на почве патологического депонирования крови и выраженных экссудативных процессов, отрицательно влияет на центральную гемодинамику. Это связано главным образом со снижением функции миокарда. На ухудшение функции миокарда оказывают воздействие два фактора: интоксикация и повышение ОПС, возникающего в результате спазма преимущественно прека-пилляров. Интоксикация и уменьшенный венозный возврат снижают УОС и МОС, что в конечном счете приводит к снижению артериального давления.
Развивающиеся при перитоните гиповолемия, гипотония и уменьшение скорости кровотока неизбежно вызывают нарушение микроциркуляции в органах и тканях организма. Последняя находится в прямой зависимости от вязкости крови, а также от проницаемости стенки капилляров, пропускающих жидкую часть крови. У больных перитонитом отмечается, как правило, спазм артериол и прекапилляров, что вызывает шунтирование кровотока и выключение из кровообращения значительного числа мелких сосудов. В результате замедления скорости кровотока и повышения вязкости крови в капиллярах образуются агрегаты эритроцитов размером 150—200 мкм [Маломан Е. Н. и др., 1976], возникает маятникообразный ток крови вплоть до стаза.
Особенно тяжелые нарушения микроциркуляции и реологических свойств крови у больных перитонитом наблюдаются в легких. Поскольку это сочетается с гиповолемией, резко ухудшается оксигенация крови. В организме быстро возникает состояние гипоксии. Развивающийся при этом ацидоз в еще большей степени ухудшает центральную и периферическую гемодинамику.
Изменения реологических свойств крови и застойное кровообращение в капиллярном русле влекут за собой гистогемическую проницаемость сосудистой стенки.
В процессе повышения проницаемости микрососудов активное участие принимают ферментотканевые системы, например гиалуронидаза, которая воздействует на эндотелий капиллярной стенки и основное вещество соединительной ткани. При этом происходит ее деполимеризация. Под воздействием токсических веществ, накапливающихся в организме при перитоните, гиалуронидаза переходит из пассивной формы кофермента в активный фермент и расщепляет гиалуроновую кислоту.
Интенсивность транскапиллярного обмена исключительно велика. В нормальных условиях в 1 мин может обмениваться более 200 л жидкости, что почти в 40 раз превышает ОЦК. Повышенная проницаемость сосудистой стенки, в частности для белка, обусловливает снижение онкотического давления плазмы крови, а проникновение его в интерстиций ухудшает обмен воды в тканях. Значительная часть циркулирующей в организме жидкости при перитоните может проникать в брюшную полость и скапливаться там (7—8 л и более, что составляет почти 50% интерстициальной жидкости).
Гипопротеин емия — одно из тяжелых проявлений перитонита. Она возникает по ряду причин: во-первых, в связи с депонированием белков крови, вышедшей из циркуляции и скопившейся в нефункционирующих сосудах брюшной полости, во-вторых, в результате расстройства белково-синтезирующей функции печени, в-третьих, на почве усиленного распада белков вследствие интоксикации организма и развивающейся фазы катаболизма на фоне голодания.
В нарушениях белкового состава крови отмечается прежде всего диспротеинемия. В основном снижена концентрация реологически активных и водоудерживающих белков крови — альбуминов. В крови увеличено содержание глобу-линов, в основном фракций а, и а^. Коэффициент А/Г сдвигается в сторону глобулинов [Сологуб В. К., 1970, и др.].
В разгар развития перитонита потери белка могут достигать 300 г в сутки, в связи с чем быстро снижается его содержание в циркулирующей крови (менее 50 г/л) [Карякин А. М., 1970].
Массивная экссудация в брюшную полость, перспирация, потоотделение, обильная рвота — все это приводит при перитоните к тяжелым потерям воды, нарушениям водно-солевого обмена и кислотно-щелочного состояния.
Причиной развития гипокалиемии является потеря иона калия в составе желудочно-кишечного содержимого или с мочой. Кроме того, ион калия может переходить из внеклеточного пространства в клеточное при явлениях выраженного алкалоза. Потеря калия может составлять более 100 ммоль/л.
Снижение содержания в крови натрия — гипонатрие-мия — встречается крайне редко, так как уменьшение объема внеклеточной жидкости стимулирует выделение альдостеро-на. Последний, как известно, задерживает выведение с мочой натрия и хлора путем реабсорбции их в почках. Одновременно усиливается выделение с мочой калия. В результате на место вышедшего из клеток калия поступают натрий и водород в соотношениях, при которых три иона калия замещаются двумя ионами натрия и одним ионом водорода [Darrow R„ Pratt P., 1950].
Наиболее часто нарушение кислотно-щелочного состояния крови у больных перитонитом обусловлено снижением содержания хлоридов (гипохлоремия). Ионы хлора могут перемещаться в воспалительные ткани, теряются с желудочным содержимым при рвоте. Потеря хлоридов может составить от 100 до 310 ммоль/л [ЧепкийЛ.П., Цер-тий В. П., 1977]. В плазме содержание ионов хлора может быть менее 90 ммоль/л.
Метаболический ацидоз наблюдается при перитоните в случаях-возникновения гипохлоремии в сочетании с гипока-лиемией и гипонатриемией. Гипернатриемия развивается при повышенной адсорбции иона натрия в почках и служит причиной развития метаболического алкалоза. Однако в дальнейшем алкалоз сменяется метаболическим ацидозом на почве усиливающегося катаболизма белков, распада жиров с выделением кислых продуктов, а также эндогенной воды, лишенной солей.
В результате ухудшения центральной гемодинамики и патологического депонирования крови в сосудах брюшной полости (анемия) нарушается кислородно-транспортная функция крови, и ткани организма больного испытывают недостаток кислорода (гипоксия).
По мере нарастания тяжести перитонита артериове-нозная разница по кислороду может достигнуть 1—2 вместо 5% по объему и норме [Цой Г. В. и др., 1976]. Причиной этого является слабость сердечной деятельности, неспособной в достаточной мере увеличить МОК и тем самым компенсировать дефицит кислородной емкости крови.
Важное место в развитии нарушений гемостаза занимает интоксикация организма. Первым барьером на пути распространения в организме больного перитонитом различных токсинов, направляющихся из брюшной полости в общий кровоток, является печень — основной обезвреживающий орган [Федоров В. Д., 1974]. Все увеличивающаяся интоксикация организма при прогрес-сировании перитонита резко снижает антитоксическую функцию печени. Заметно уменьшается концентрация в крови р- и у-глобулинов, что отрицательно сказывается на течении инфекционного процесса [Стручков В. И., 1976, и др.].
Депрессия функции печени сказывается снижением ее способности к мочевинообразованию. Нарушение функции связывания аммиака ухудшает синтез белка. В организме накапливаются продукты обмена, свидетельствующие о снижении энергетических процессов: в крови появляются в большом количестве мочевина, остаточный азот, креатинин, билирубин и др. [Карякин А. М., 1970; Сулима С. Я., 1970]. О нарушениях функции печени говорят также нарушения в системе лимфообращения, в частности затрудненный лим-фоотток, который служит своеобразным регулятором водного и белковсчо обмена.
Токсины, циркулирующие в крови, определенным образом влияют на клетки крови, прежде всего на тромбоциты. Они приобретают повышенную склонность к адгезии и агрегируют в кровотоке, создавая микросгустки. В сочетании с агрегирующими эритроцитами они образуют более крупные сгусгки, препятствующие кровотоку и вызывающие его шунтирование.
Подвергаясь вязкому метаморфозу, тромбоциты выделяют ряд веществ, в том числе адреналин и норадреналин, вызывающие спазм периферических сосудов. Наблюдаются
застой крови, нарушение целостности сосудистой стенки, выхождение крови в паравазальные пространства вплоть до кровоизлияний. Рефлекторно в крови повышается содержание фиброгена, способствующего так называемой структурной гиперкоагуляции.
Таким образом, появление в циркуляции микросгустков и шунтирование кровотока наряду с повышенной кровоточивостью создает условия для развития тромбогеморрагического синдрома, или диссеминированного внутрисосудисто-го свертывания (ДВС), впервые описанного R. M. Hardway (1965).
Клинические проявления патофизиологических сдвигов при перитоните. Клиника перитонита — это проявления патофизиологических сдвигов в организме больного. Будучи обобщены в соответствующих классификациях по различным признакам, они служат для врача опорой при постановке задачи и выборе той или иной трансфузионной терапии.
Перитонит классифицируют по:
а) клиническому течению: острый, нодострый, хронический;
• б) степени распространенности процесса: местный (ограниченный, осумкопанный), распространенный (диффузный, разлитой, общий);
в) происхождению: первичный (эссенциальный), вторичный (патологический, травматический, послеоперационный);
г) характеру выпота: серозный, серозпо-фибринозный, фибринозный, гнойный, гнилостный, геморрагический, слипчивый;
д) этиологическому фактору: асептический, бактериальный, специфический.
Обоснованный диагноз служит указанием на то, какое лечение следует применить - хирургическое, терапевтическое или комбинированное.
Для трансфузионной терапии эти классификации имеют особое значение, так как, во-первых, могут служить основой для определения задач лечения и, во-вторых, ориентируют врача в отношении выбора того или иного средства для нормализации гомеостаза на данном этапе патологического процесса. Так, инфузионная терапия зависит от того, как протекает процесс (остро или хронически, местно или распространенно), является ли перитонит осложнением какого-то заболевания или травмы, как далеко зашел процесс (серозный, гнойный или геморрагический) и т.д. Все эти факторы во многом определяют программу инфузи-онной терапии в разных фазах развития перитонита, ее интенсивность и продолжительность.
Клиническая картина перитонита подробно описана в соответствующих руководствах. Нет надобности на ней останавливаться, тем более что наша задача заключается не в обсуждении лечения перитонита вообще, а в выявлении тех симптомов, которые служат основой для построения программы инфузионно-трансфузионной терапии, имеющей патогенетический характер.
Клинические проявления нарушений центральной гемо-динамики обусловлены в первую очередь развитием гиповолемии. Патологическое депонирование крови, централизация кровообращения, а также массивная экссудация жидкости в брющную полость из сосудистого русла усугубляются обильной рвотой, гипертермией, потоотделением, одышкой.
В результате снижения ОЦК наблюдается артериальная гипотония. Одновременно со снижением артериального повышается ЦВД. Однако венозная гипертензия бывает лишь в начале заболевания, а затем, по мере увеличения гиповолемии, она постепенно снижается. Нарастает тахикардия, уменьшается разница между максимальным и минимальным артериальным давлением, тоны сердца становятся глухими, пульс малого наполнения и напряжения, мягкий [Цой Г. В. и др., 1976]. На ЭКГ электровозбудимость миокарда снижается соответственно уменьшению УОС и МОК. О нарушении внутрисердечной электропроводимости свидетельствует также гипокалиемия.
Вместе с тем следует отметить, что относительное благополучие центральной гемодинамики при перитоните далеко не всегда отражает истинное положение дела. В ряде случаев поддержание артериального давления на относительно удовлетворительном уровне достигается ценой ухудшения периферического кровотока, сокращенного в результате его шунтирования через артериоло-венулярные анастомозы. Укорочение пробега крови уменьшает тканевый кровоток, выключая его из общего кровообращения.
Нормальные цифры артериального давления при перитоните нельзя считать объективно отражающими состояние больного. Они могут маскировать гиповолемию при перераспределении крови в организме и дезориентировать врача при выборе инфузионной тактики.
Глубинные процессы гемодинамики, происходящие на уровне микроциркуляции, трудно распознать в условиях клиники. О нарушениях реологических свойств крови и микроциркуляции косвенно свидетельствует лабораторное исследование крови больного на вязкость с помощью ротационных или капиллярных вискозиметров. В определенной мере на повышение вязкости крови может указывать СОЭ. При повышении вязкости крови увеличивается агрегабельность эритроцитов: они быстро складываются в монетные столбики и оседают, теряя суспензионную активность.
Повышенная вязкость крови, агрегация эритроцитов, микросгустки способствуют шунтированию кровотока через прекапилляры и артериолы. Ногтевые ложа, кожные и слизистые покровы становятся бледными, температура на этих участках тела снижается. В тканях накапливаются продукты обмена и в крови обнаруживается сдвиг рН в сторону ацидоза. Нарушение функции легких проявляется одышкой.
Длительный застой в капиллярном русле вызывает нарушения проницаемости стенки сосудов, в результате чего можно наблюдать мелкоточечные кровоизлияния, особенно выраженные на слизистых оболочках. Нарушение капиллярного кровообращения характеризует тяжелую стадию развития перитонита.
Нарушения транскапиллярного обмена при перитоните обусловлены, во-первых, повышением проницаемости стенок микрососудов в связи с застоем крови и интоксикацией и, во-вторых, изменениями онкотнческого и гидростатического давлений по обе стороны сосудистой диализирующей мембраны, пропускающей воду и соли и не пропускающей в обратном направлении белки крови.
Водно-солевой обмен играет исключительно важную роль. По данным Я. Горжейши (1967), при массе тела 60 кг общее количество воды в организме составляет 24 л. Потребность в воде составляет в среднем 400 мл/кг. Брюшина принимает наибольшее участие (30—70 л/ч) в водном обмене [Симонян К. С., 1971]. Жажда — один из важных признаков нарушения водного обмена у больного перитонитом. Она возникает уже при потере воды, составляющей 6% массы тела. Эти потери значительно выше в связи с наличием у больных отеков ткани, экссудации в просвет кишки, гипертермии, одышки и т.д. Кроме того, потере воды может способствовать выведение жидкости из желудка зондом.
Пробой на степень дегидратации организма при перитоните может служить время рассасывания 0,5 мл раствора Рингера, введенного внутрикожно на внутренней поверхности предплечья (норма 45—60 мин).
Потери циркулирующего белка вначале связаны с его депонированием в составе застойной крови в сосудах брюшной полости, а затем с образованием воспалительного экссудата, гнойного содержимого, фазы катаболизма и нарушением функции печени. За сутки может теряться более 30—80 г из нормально циркулирующих в организме 300—400 г белков, причем 50% потерь приходится на альбумины. Критическим снижением концентрации общего белка в крови больного считается уровень 50 г/л. При изучении белковых фракций обращает на себя внимание диспротеинемия.
Электролитные потери при перитоните, связанные с обильной рвотой, отмыванием содержимого желудка зондом, избыточное потоотделение, потери с мочой и т.д. в значительной мере нарушают солевой баланс организма. С помощью биохимических анализов периферической крови удается своевременно регистрировать нарушения электролитного состава крови и выявлять патофизиологические сдвиги в организме больного.
При количественном анализе крови на содержание в ней ионов калия или натрия может быть обнаружена гипокалие-мия или гипонатрнемия, наблюдаемая при развитии перитонита, а также гипохлоремия, что имеет не менее важное значение для диагностики.
Возникающие при перитоните нарушения кислотно-щелочного состояния диагностируются путем определения показателя рН, BE, SB и др., указывающих на развитие в организме ацидоза или алкалоза. Получение этих показателей в условиях клиники не представляет трудностей. Без их использования инфузионная терапия не может быть целенаправленной.
Клинически нарушения кислородно-транспортной функции крови проявляются бледностью кожных и слизистых покровов. Наиболее информативным является изучение газов крови. В качестве показателей могут быть использованы напряжение кислорода (Ро ), насыщение кислородом, содержание кислорода в артериальной и венозной крови (в процентах по объему), утилизация кислорода и потребление его в минуту.
Самыми доступными показателями, характеризующими степень снижения кислородной емкости крови, являются содержание гемоглобина, а также число эритроцитов и гематокрит. Однако при значительном снижении ОЦП гематокрит может оказаться недостоверным, так как отражает лишь отношение ОЦЭ к ОЦП.
Помимо признаков гипоксии, обусловленной анемией, у больных перитонитом ярко выражены проявления интоксикации. Это проявляется слабостью, вялостью, усилением рвоты, ухудшением функции сердца, печени, почек. В крови возрастает число лейкоцитов, извращается формула крови, повышается СОЭ. По мере ухудшения функции печени снижается содержание общего белка, об угнетении иммунных систем организма свидетельствует снижение концентрации J3- и у-глобулинов. Постепенно в плазме накапливаются продукты обмена — мочевина, остаточный азот, креатинин и др.
Интоксикация организма служит источником изменения ряда факторов свертывающей системы крови. Появляется реальная опасность развития диссеминированного внутрисо-судистого свертывания на почве тяжелых нарушений реологических свойств крови, микроциркуляции, белкового состава крови, кислотно-щелочного состояния и т.д. При клинико-лабораторных исследованиях выявляются токсические изменения в качественной характеристике тромбоцитов. Они легко агрегируют, разрушаются и из них выходит в кровь тромбопластиноподобный фактор. При тяжелых формах перитонита отмечается перераспределение тромбоцитов в кровеносном русле: на периферии они скапливаются, а в сосудах макроциркуляции их содержание заметно уменьшается [Мордашов Б. К., 1975]. Наряду с этим воспаление брюшины нарушает функцию эндотелия, что сопровождается выходом в кровь тромбина, концентрация которого в периферической крови резко возрастает. Все это вместе взятое существенно повышает риск развития ДВС [Левин Ю. М., 1973].
Клинические проявления синдрома ДВС бывают весьма скудными и для его диагностики необходимы сложные биохимические исследования крови больных. Вместе с тем . данные, полученные in vitro, не обязательно коррелируют с процессами, происходящими в организме больного. В связи с этим изменения отдельных параметров гемостаза, выявленные лабораторным путем, не всегда могут иметь решающее значение для своевременного и правильного распознавания претромботического состояния крови пациента [Кудряшов Б. А., 1975, и др.].
Основными биохимическими тестами являются повышенное потребление коагулирующих факторов в процессе свертывания (коагулопатия свертывания) и вторичная активация фибринолитической системы крови [Мачабели М. С., 1970].
Важным показателем развития в организме больного синдрома ДВС может быть повышение в крови концентрации растворимого фибрина-мономера (фибриноген В) наряду с повышением содержания в крови продуктов деградации фибриногена. Фрагменты фибриногена D (молекулярная масса 83 000) и фибриногена Е (молекулярная масса 35 000) образуют неполноценные (нестабильные) сгустки крови (реакция паракоагуляции). В то же время стабильные мономерные сгустки, образованные фибриногеном В, могут вызывать тромбоз в просвете прекапилляров, артериол и венул tChang Т. S. et al., 1974; Butler М. I. et al., 1976].
Таким образом, выявление в крови больного перитонитом качественно измененных тромбоцитов, скапливающихся на периферии, повышенное содержание фибриногена В наряду с увеличением содержания продуктов деградации и наличие петехий должны насторожить врача в отношении возможного развития у больного ДВС.
Трансфузионная терапия. В настоящее время вопросы хирургической тактики при перитоните в основном решены. Улучшение результатов лечения возможно путем совершенствования лекарственной и главным образом инфузионной терапии. Коррекция нарушения гомеостаза и борьба с инфекцией — основные задачи лечения на современном этапе.
Нарушения гомеостаза, или патофизиологические сдвиги, в организме больного перитонитом нуждаются в своевременной и целенаправленной корреляции с помощью трансфузионных средств направленного действия. Это воздействие на организм больного должно быть строго патогенетическим на всех этапах его лечения: предоперационном, операционном и послеоперационном. Необходимо учитывать характер, стадию, степень и другие особенности перитонита, отраженные в классификациях.
Предоперационный период. Подготовка больного к оперативному вмешательству играет исключительно важную роль в предупреждении срыва компенса-торных механизмов как во'время самой операции, так и в раннем послеоперационном периоде. Предоперационная терапия должна носить характер реанимационных мероприятий, направленных на максимально быстрое и возможно полное восстановление всех жизненно важных функций организма, без чего выполнение оперативного пособия невозможно.
Как справедливо считает В. Д.Федоров (1974), у больных с тяжелой формой перитонита, у которых общая продолжительность заболевания составляет не менее 24—48 ч, задержка операции для соответствующей подготовки на 2—3 ч вполне оправдана.
Для восполнения дефицита ОЦК, преимущественно его плазменного компонента, необходимо вливание раствора, способного увеличивать коллоидно-осмотическое давление плазмы крови и длительно циркулировать в кровеносном русле больного. Наиболее подходящим для этих целей является раствор полиглюкина. Он быстро и надежно восполняет дефицит ОЦК и повышает артериальное давление до безопасного уровня.
Учитывая ограниченность времени подготовки к операции, скорость инфузионной терапии следует увеличить в пределах 60—120 капель в минуту, а объем инфузии может быть в пределах 1—1,5л в зависимости от эффекта восстановления Показателей центральной гемодинамики (пульс, артериальное и центральное венозное давление).
С целью нормализации э лектролит-ного состава крови, в частности восполнения дефицита натрия и калия, показано применение раствора Рингера, содержащего хлориды натрия, калия, кальция, а также бикарбонат натрия. Этот сложный эквилибриро-ванный раствор может быть использован в основном для коррекции электролитного состава крови, но он малоэффективен в отношении нормализации кислотно-щелочного состояния.
Для коррекции кислотно-щелочного состояния организма более эффективен раствор Гартмана, содержащий, кроме хлоридов натрия, калия и кальция, лактат натрия в качестве буферной добавки, способной сбалансировать нарушенное равновесие. В равной мере может бы^ь использован лактасол, содержащий, кроме хлоридов натрия, калия и кальция, бикарбонат и лактат натрия, т.е. обе буферные добавки. Объем инфузии этих растворов зависит от эффекта их действия, о чем следует судить по данным биохимического анализа крови на содержание натрия, калия, хлора, а также по показателям кислотно-щелочного состояния. Сред-\шп объем ннфузии составляет 0.4—0,8 л.
Роль л е к а р с т в е н ной терапии сугубо вспо-мог;: ,,ел1:ная. Она до-чжна быгь направлена на повышение эффектий.{г^ти инфузионных средств путем улучшения d:vs,K:.:H.i миокарда н повышения тонуса сосудов (гормоны, се^'.-i'^se, сосудистые препараты).
О ?г е р а 11 и о н н ы и п с р и о л. Инфузионная тера-пнч, с помощью ко горой больной был подготовлен к операции, в операционный период продолжается в том же H.^ri рая/те иии „ т. с. поддерживаются необходимый уровень поле-мии и нормальное К1ДС.
К о м п е н с а ц и я о п е р а ц и о н н о и к р о в о-u о г с р и наиболее эффективно достигается ин-фузиси по.'«и1люкина. Точнее, продолжают введение этого препарата, начатое на предыдущем этапе. Полиглюкин оказывает положительное влияние на функцию миокарда, так как нормализация волемии Повышает У ОС и МОК при условии снижения ОПС. В результате этого артериальное и центральное венозное давление стабильно удерживается на безопасном уровне.
Инфузия полиглюкина должна сочетаться с кристалло-идными растворами в тех же соотношениях и объемах, которые рекомендованы в главе III.
Гемотрансфузия показана лишь тогда, когда вследствие операционной кровопотери кислородная емкость крови становится ниже критической. В типичных случаях общий объем донорской крови не должен превышать 1—1,5 л.
Для коррекции кислотно-щелочного состояния продолжают вливание сложных солевых сбалансированных растворов (растворы Рингера, Гартмана, лактасол), контролируя показатели рН и BE.
Послеоперационный п е р и о д лечения перитонита является завершающим и основным. В задачи инфузионной терапии на этом этапе входят окончательное восстановление в полном объеме всех жизненно важных функций организма, нормализация его гомеостаза. Поскольку после операции, как правило, полностью исключается энтеральное питание, внутривенное введение лечебных препаратов является наиболее эффективным методом коррекции и поддержания гомеостаза.
На передний план опять-таки выдвигается задача регуляции волемии н нормализация центральной гемодинамики. Без этого условия невозможно проводить дальнейшее лечение.
В связи с тем что на предыдущих этапах использовали полиглюкин, в послеоперационном периоде целесообразно начать введение реополиглюкина. С одной стороны, он позволяет бороться с гиповолемией, с другой — удается активно воздействовать на вязкость крови и тем самым осуществить одну из важных задач — улучшить м и-к р о ц и р к у л я и, и ю.
Однако реополиглюкин привлекает к себе воду из интерстиция (1 г декстрана связывает 20—25 мл воды) и в течение суток выводится из организма в объеме 70% введенного. Следовательно, при выраженном обезвоживании организма нужно применять реополиглюкин с большой осторожное гью, чтобы не усугубить нарушения водного обмена, которые всегда развиваются при перитоните.
Из числа низкомолекулярных каллоидных растворов можно использовать также желатиноль, оптимум молекулярной массы которого находится в пределах 10 000—20 000. Это и определяет его реологические свойства, необходимые для разжижения сгущенной крови. Однако за последнее время появились сообщения о недостаточной реологической активности этого препарата [Савельев В. С., 1976; Шанин Ю. Н. и др., 1978, и др.].
При разлитом гнойном перитоните объем инфузии реологически активных препаратов, в частности реопо-лиглюкина, может составлять 1—1,5л в сутки, но при условии нормальной функции почек [Кузин М. И. и др., 1977].
В качестве средств вспомогательной терапии используют гепарин, обладающий антикоагулянтным и реологическим действием, а также ингибиторы кикиновой системы — трасилол, контрикал и их аналоги.
Борьба с обезвоживанием организ-м а, возникающим на почве нарушения транскапиллярного обмена, с проникновением жидкости в так называемое третье пространство, заключается в массивных вливаниях солевых растворов, содержащих натрий. В качестве простого солевого раствора широко используют изотонический раствор хлорида натрия. Его преимуществом является то, что он легко проникает через полупроницаемые мембраны капиллярных сосудов и быстро восполняет дефицит интерстициальной жидкости. При нормальной функции сердца и почек массивные инфузии раствора в объеме 2—3 л безопасны, так как его излишки, не проникшие в интерстиций, легко выводятся с мочой.
Контроль за инфузией изотонического раствора хлорида натрия может осуществляться путем определения содержания в крови натрия, а также прямого определения водных пространств (общей воды, внутриклеточной, внеклеточной — интерстициальной и внутрисосудистой — с помощью роданистого натрия, тиоцианата натрия, тиосульфата натрия, антипирина, мочевины, алкоголя, декстрана) или другими методами. Однако в условиях стационара эти способы диагностики используют весьма редко.
Развивающаяся при перитоните гипопротеинемия в значительной мере ухудшает течение болезни, а в далеко зашедших случаях — и прогноз. Она представляет собой в основном гипоальбуминемию.
Учитывая исключительную роль альбумина, поддерживающего онкотическое давление плазмы и обусловливающего реологические свойства крови, а также его дезинтоксикационные свойства, участие этого белка в белковом и жировом обмене, в переносе лекарственных веществ и т.д., при лечении белковой недостаточности следует прежде всего проводить альбуминотерапию. Альбумин обладает высоким онкотическим давлением, исключительной реологической активностью и высокой гигроскопичностью. Отсюда следует, что препарат альбумина способен активно повышать к оллоидно-осмотическое давление плазмы. Однако при этом происходит дегидратация интерстиция, что у больных перитонитом с нарушенным балансом межклеточной жидкости представляет определенную опасность.
Наиболее приемлемо переливание 5% раствора альбумина, концентрация которого не слишком велика и вполне допустима у больных перитонитом, тем более, что 5 г альбумина удерживают 100 мл жидкости, в которой он растворен.
В равной мере может быть использован препарат донорской крови протеин. Раствор содержит около 5% белков, из которых альбумин составляет 80—85%, а остальные 15—20% — а- и Р-глобулины. По онкотическим свойствам препарат аналогичен плазме. Доза инфузии альбумина и протеина может составлять 0,8—1,2 л и более.
Кроме альбумина и протеина, с целью нормализации белков крови больного при перитоните могут быть использованы препараты парентерального питания, что особенно важно в послеоперационном периоде. С этой целью показаны гидролизин Л-103, гидролизат козеина ЦОЛИПК, а также новый отечественный препарат полиамин. Все эти препараты содержат наборы аминокислот, в том числе незаменимых, и низкомолекулярные пептиды.
Нормализация электролитного состава крови больного имеет исключительно важное значение для восстановления и поддержания нормальной функции жизненно важных органов — сердца, печени, почек и др. При лечении перитонита широко используют современные сложные солевые растворы (Рингера, Гартмана), содержащие в определенных соотношениях (эквилибриро-ванные) все необходимые электролиты: натрий, калий, кальций, а в отдельных случаях магний (например, лактасол). Инфузионная коррекция электролитного состава крови проводится под контролем содержания в крови калия, кальция, натрия, магния и хлоридов. Объем инфузии этих растворов может составлять 1—1,5 л и более.
Следует отметить, что наиболее трудно поддается коррекции дефицит калия в клетках, так как проникновение его в клеточную жидкость сопровождается значительными энергетическими затратами. С целью стимуляции и облегче ния этого процесса использую! сбалансированные растворы в сочетании с введением глюкозы с инсулином (1 ЕД инсулина на 3—4 г сухого вещества глюкозы). Вводить растворы калия рекомендуется только при удовлетворительной функции почек (диурез не менее 50 мл/ч) и содержания его в плазме крови ниже 4 ммоль/л. Вводимый раствор не должен содержать калия более 30—40 ммоль/л. Макси^ мальная суточная доза калия 3 ммоль/кг (0,22 г КС1). Максимальная скорость введения раствора в кровь больного не более 20 ммоль/ч, т.е. 782 мг калия. Быстрое введение в организм калия может вызвать передозировку, что опасн
