Строение дибазола и физико-химические свойства
Дибазол – это гигроскопичный белый порошок, слегка с сероватым оттенком, горько-солёного вкуса. Температура плавления 182 -186 ºC. Трудно растворим в воде, легко – в спирте, трудно или практически нерастворим в других органических растворителях, имеющий две формы:
1) 2-(Фенилметил)-1H-бензимидазол

2) В виде гидрохлорида

Дибазол является производным имидазола, с бензойным радикалом.

Имидазол обладает ароматическими свойствами. Атом N-1 обусловливает кислотность имидазола – способность образовывать соли щелочных и щелочно-земельных металлов. По атому N-1 легко образуются также N-алкил-, N-арил-, N-ацилпроизводные и другое. Атом N-3 – нуклеофильный центр, по которому протекают протонирование, кватернизация и комплексообразование. Наличие атомов N двух типов способствует электрофильному замещению в положения 4 и 5, нуклеофильному – в положение 2. Карбоксилирование имидазола протекает в положения 4 и 5, металлирование N-алкил- и N-аралкилпроизводных – в положение 2.
Имидазол устойчив к действию большинства окислителей и восстановителей: не окисляется HNO3, Н2СrО4, КМnО4, но расщепляется под действием пероксидов; не восстанавливается амальгамой Na, Zn/HCl, HI при 300 °С. N-Ацетилимидазолы в присутствии Pd-катализаторов в уксусной кислоте гидрируются в тетрагидроимидазолы (имидазолидины), которые легко гидролизуются до диаминов [2, 3, 16]. Бензойный радикал проявляет все свойства ароматического соединения c реакциями электрофильного замещения.
1.3. Способы получения препарата Дибазола
Впервые 2-бензилбензимидазол был синтезирован в 1899 г. немецкими химиками Рихардом Вальтером и Т. Пулавски (R. Walther, Th. Pulawski) длительным нагреванием о-фенилендиамина с небольшим избытком фенилуксусной кислоты до 180°C. В конце 1940-х годов Оскар Фёдорович Гинзбург детально изучил кислотно катализируемую конденсацию о-фенилендиамина с карбоновыми кислотами, приводящую к образованию 2-алкил- и 2-арилбензимидазолов, и установил ее механизм.
2-Бензилбензимидазол был получен им нагреванием в запаянной трубке эквимолярной смеси о-фенилендиамина и фенилуксусной кислоты в 10% соляной кислоте в течение 40 мин при 180-185°C с выходом 98% [10].

Гидрохлорид был выделен кристаллизацией свободного основания из 5% соляной кислоты.

Этот способ получения 2-замещенных производных бензимидазола в 1947 г. был защищен авторским свидетельством. Гетероциклизацию о-фенилендиамина с фенилуксусной кислотой можно осуществить не только под давлением, но и при атмосферном давлении, а также в условиях микроволновой активации.
Предложенный в 1947 г. О.Ф. Гинзбургом, Л.С Эфросом и Б.А. Порай-Кошицем способ получения 2-бензилбензимидазола лег в основу промышленной технологии Дибазола: первый технологический регламент получения лекарственной субстанции Дибазола нагреванием о-фенилендиамина с фенилуксусной кислотой в солянокислой среде при атмосферном давлении. Промышленный выпуск Дибазола впервые был осуществлен на этом заводе несколько раньше, в 1950г. Впоследствии на этом производстве, вплоть до его остановки в 2004 г., вместо фенилуксусной кислоты использовали ее нитрил [7, 9].
В аппарат с мешалкой и приварной рубашкой загружают о-фенилендиамин и фенилуксусную кислоту из бункера. Реакционную массу нагревают до 200°C подачей дифенилметана в рубашку аппарата. Дифенилметан подогревается в нагревателе с электрической спиралью. Отработанный дифенилметан через кожухотрубчатый теплообменник возвращают в линию дифенилметана. В межтрубное пространство теплообменника подается охлаждающая вода, которая затем также возвращается в цикл насосом. Пары воды из реактора поступают в дефлегматор часть конденсата возвращают в аппарат, а другую часть сливают в канализацию. Дефлегматор охлаждают подачей воды в межтрубное пространство, которую затем возвращают в цикл насосом. Когда реакционная масса нагреется до 200°C, обогрев снимают (примерно через 3 часа) и ведут охлаждение реакционной массы. После охлаждения реакционной массы до 110°C (в течение 1,5 часов) охлаждение прекращают и в аппарат загружают воду из мерника и соляную кислоту из мерника. Реакция в аппарате идет примерно в течение часа при перемешивании и нагреве реакционной смеси до 96°C дифенилметаном.
По окончании реакции снимают обогрев и реакционную смесь из аппарата центробежным насосом перекачивают в кристаллизатор (снабженный рамной мешалкой и приварной рубашкой), загружают активированный уголь, соляную кислоту из мерника, 1% раствор двухромовокислого калия. Затем ведут процесс нагрева реакционной смеси до температуры кипения растворителя. После разогрева реакционной смеси до 100°C и протекания процесса растворения, обогрев снимают и реакционную массу перекачивают центробежным насосом, где происходит горячая фильтрация. После фильтрования реакционная масса самотеком поступает в кристаллизатор, где охлаждается подачей воды в рубашку аппарата. При охлаждении до 20°C выпадает осадок гидрохлорида 2-бензилбензимидазола. Процесс перекристаллизации проводят еще два раза с использованием для перекристаллизаций маточных растворов от предыдущих перекристаллизаций. Вторая и третья перекристаллизации ведутся только с осветлением углем. После перекристаллизации осадок гидрохлорида 2-бензилбензимидазола направляют направляют на фильтрацию в барабанный вакуум-фильтр . Дибазол после сушки направляют на таблетирование и упаковку [9].
В настоящее время в промышленном синтезе Дибазола в качестве предшественника бензильного фрагмента используют не только фенилуксусную кислоту или ее нитрил, но также и ее амид (фенилацетамид), при этом во всех случаях пятичленный цикл формируется комбинацией фрагментов [4,7,9]

В постперестроечные годы субстанцию и лекарственные формы Дибазола производили многочисленные предприятия России и ближнего зарубежья, некоторые из них продолжают выпуск этой продукции и в настоящее время.
1.4. Биологическая роль Дибазола
Обладает гипотензивным, сосудорасширяющим действием, стимулирует функцию спинного мозга. Оказывает непосредственное спазмолитическое действие на гладкие мышцы кровеносных сосудов и внутренних органов. Облегчает синаптическую передачу в спинном мозге [1, 2, 14].
Иммуностимулирующая активность связана с регуляцией соотношения концентраций цГМФ (Циклический гуанозинмонофосфат) и цАМФ (Циклический аденозинмонофосфат) в иммунных клетках (повышает содержание цГМФ), что приводит к пролиферации зрелых сенсибилизированных T- и B-лимфоцитов, секреции ими факторов взаимного регулирования, кооперативной реакции и активации конечной эффекторной функции клеток [13, 14,11]. Снижает содержание свободного кальция в гладких мышцах, вызывая их расслабление; повышает синтез нуклеиновых кислот и белков, стимулирует иммунную систему (способствует образованию антител, фагоцитозу, синтезу интерферона). Активирует межнейронные контакты в спинном мозге. Обладает непродолжительным (2-3ч) и умеренным гипотензивным эффектом, хорошо переносится. Вызывает расширение (непродолжительное) мозговых сосудов и поэтому особенно показан при формах артериальной гипертензии, обусловленных хронической гипоксией мозга из-за местных нарушений кровообращения (склероз церебральных артерий) [4, 12, 15].
Глава 2. Методы определения препарата дибазол
2.1. Качественный анализ дибазола
Для качественного анализа Дибазола на подлинность, существует множество реакций. Наиболее практичной, дающей хороший аналитический эффект, считается реакция образования красно-серебристого осадка полийодида. Для начала определения подлинности препараты дибазола надо подготовить [17].
0,5 г порошка растертых таблеток и 10 мл воды. Порошок растворяют в воде и фильтруют. Фильтрат дает реакции подлинности. Для ампулированной формы препарата их раствор сразу применяем для анализа.
1.Образование полийодида
В 3-5 мл воды растворяют 0,01-0,02 г препарата, прибавляют 3 капли разведённой соляной кислоты, 2-3 капли 0,1 н. раствора йода и взбалтывают. Образуется красно-серебристый осадок полийодида состава:

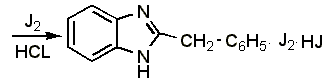
Реакцию проводят при температуре не выше 25°.
2. Образование серебряной соли
Растворяют 0,05 г препарата в 5 мл воды и прибавляют 1,5 мл 25%-ного раствора аммиака. Образующийся осадок отфильтровывают, к фильтрату, подкисленному азотной кислотой, прибавляют 1 мл 2%-ного раствора нитрата серебра. Выпадает белый осадок.

3. Реакция окисления ванадатом аммония
В 1 мл хлороформа растворяют 0,01-0,02 г препарата, прибавляют 3-5 капель 1% раствора ванадата аммония в концентрированной серной кислоте и встряхивают. Слой хлороформа постепенно окрашивается в вишнёвый цвет.
4. Реакция с нитратом кобальта
К 0,01 г препарата прибавляют 3 капли 3% спиртового раствора нитрата кобальта. Образуется голубое окрашивание.

5. Реакция с концентрированной серной кислотой
К нескольким крупинкам препарата прибавляют 5-6 капель концентрированной серной кислоты. При этом образуется оксониевая соль, что вызывает появление ярко-жёлтого окрашивания, постепенно переходящего в кирпично-красное. От прибавления нескольких капель воды окраска исчезает.
6. Реакция с серной и азотной кислотами
Несколько крупинок препарата помещают в пробирку и прибавляют 2 мл смеси, состоящей из 1 мл концентрированной азотной кислоты и 9 мл концентрированной серной кислоты. Появляется красное окрашивание. Прибавляют по каплям при постоянном помешивании и охлаждении 5 мл воды. Окраска переходит в коричневую, жёлтую, а затем в оранжевую. При взбалтывании полученного раствора с 3 мл хлороформа хлороформный слой окрашивается в фиолетовый цвет.
7. Реакция с сульфатом меди и роданидом аммония
Крупинку препарата растворяют в капле воды и прибавляют по 1 капле 0,1н. раствора соляной кислоты, 3% раствора сульфата меди и 2% раствора роданида аммония. Появляется коричневый осадок.
8. Реакция осаждения основания дибазола
К водному раствору прибавляют раствор гидроксида аммония, выделяется основание дибазола, которое отделяют фильтрованием, а в фильтрате хлорид ион доказывают по реакции с нитратом серебра.

NH4Cl+AgNO3 = AgCl↓ + NH4NO3
AgCl + 2NH3*H2O = [Ag(NH3)2]Cl + 2H2O
