Разделы курса, знания которых необходимы для выполнения и защиты лабораторной работы
1. Упругая и пластическая деформация.
2. Дефекты кристаллического строения и их влияние на прочностные характеристики металлов и сплавов.
3. Механические свойства и методы их определения (твердость, прочность, пластичность, ударная вязкость)
ЛАБОРАТОРНАЯ РАБОТА №4
ДИАГРАММА СОСТОЯНИЯ И СТРУКТУРА СПЛАВОВ СИСТЕМ «МЕДЬ – НИКЕЛЬ» И «СВИНЕЦ – СУРЬМА»
- Цель работы
1.1. Научиться, пользуясь диаграммами состояния, анализировать формирование структуры сплавов при изменении химического состава и температуры.
1.2. Ознакомиться со структурами сплавов систем «медь – никель» и «свинец – сурьма» в равновесном состоянии.
- Основные понятия теории сплавов
Металлический сплав представляет собой макроскопически однородное вещество (систему), полученное сплавлением (соединением в жидком состоянии) двух или большего числа металлов (реже металлов и неметаллов) и имеющее характерные металлические свойства.
Индивидуальные химические вещества (химические элементы, устойчивые химические соединения), при сплавлении которых образуется сплав, называются компонентами.
Компоненты сплава при сплавлении вступают между собой в физико-химическое взаимодействие, что приводит к образованию в сплавах различных фаз. Фаза представляет собой однородную по химическому составу, строению и свойствам часть системы, отделённую от других частей системы (фаз) границей раздела. При переходе через границу раздела фаз свойства меняются скачком.
В жидком состоянии большинство металлических сплавов представляют собой однородные жидкие растворы. В твёрдом состоянии могут образовываться твёрдые растворы, промежуточные фазы (химические соединения) и смеси фаз.
Твёрдыми растворами называют кристаллические фазы переменного состава, при образовании которых кристаллическая решётка одного из компонентов (растворитель) сохраняется, а атомы других (растворённые компоненты) занимают места в кристаллической решётке растворителя.
Различают твёрдые растворы замещения и твёрдые растворы внедрения. При образовании твёрдых растворов замещения атомы растворённого компонента замещают атомы растворителя в узлах его кристаллической решётки (Рис.1,а), а при образовании твёрдых растворов внедрения атомы растворённого компонента располагаются в порах между узлами кристаллической решётки растворителя (Рис.1, б).
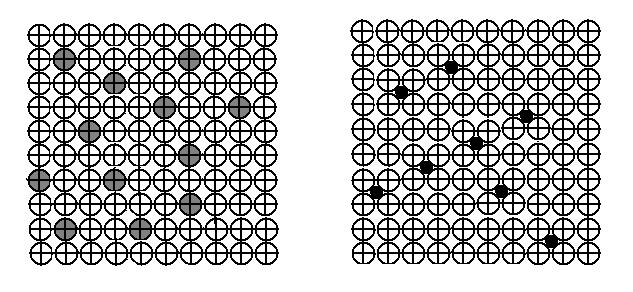
а) б)
Рис. 1. Схема строения твердых растворов замещения (а) и внедрения (б)
При изменении количественного соотношения компонентов твёрдые растворы сохраняют свою однородность. Растворимость компонентов в твёрдом состоянии может быть ограниченной и неограниченной. При образовании твёрдых растворов внедрения растворимость всегда ограничена. Растворимость по типу замещения может быть как ограниченной, так и неограниченной. Неограниченная растворимость проявляется при соблюдении определённых условий:
1) компоненты должны иметь однотипную кристаллическую решётку;
2) разница в величине атомных радиусов компонентов не должна превышать 8-15 %;
3) компоненты должны иметь близкое строение валентной элек-тронной оболочки атомов.
- Диаграммы состояния
В зависимости от изменения внутренних факторов (концентрация компонентов) и внешних факторов (температура, давление) изменяется фазовое состояние системы: образуются и исчезают фазы, меняется их химический состав и относительное количество.
Все эти изменения состояния сплавов удобно отображать графически в виде диаграммы состояния. Диаграмма состояния характеризует изменение фазового состояния сплавов в зависимости от их состава и температуры. Любая точка на диаграмме состояния отображает фазовое состояние конкретного сплава при конкретной температуре. Вид диаграммы состояния зависит от характера взаимодействия компонентов при изменении концентрации и температуры.
Диаграмма состояния системы «медь-никель»
При сплавлении этих металлов образуется неограниченные твердые растворы замещения, не образуются химические соединения и механические смеси фаз.
Медь и никель имеют одинаковую решётку (ГЦК) и близкие атомные радиусы (Сu – 0,128 нм, Ni – 0,125 нм).
Линия асв на диаграмме состояния Сu – Ni (рис. 2) называется ликвидус ﴾от слова liquidus (лат.) – жидкий﴿. Выше этой линии все сплавы данной системы находятся в жидком состоянии. Линия адв называется солидус (solidus ﴾лат. ﴿- твердый ﴿. Ниже этой линии все сплавы находятся в твердом состоянии. Между ликвидусом и солидусом одновременно находятся две фазы: жидкий и твердый растворы. Чтобы охарактеризовать фазовое состояние конкретного сплава при заданной температуре, необходимо определить природу фаз, находящихся в равновесии при данной температуре, их химический состав и относительное количество. Для примера рассмотрим изменение фазового состояния, происходящее при снижении температуры в сплаве, содержащем 30 % Ni и 70 % Сu (см рис. 2).

Рис. 2. Диаграмма состояния системы «медь – никель».
Для определения фазового состояния сплава в интервале кристал-лизации применяют правило отрезков. Например, при произвольно выбранной температуре t1 (см. рис. 2) через точку К, лежащую на ординате сплава, проводят горизонтальную линию - изотерму - до пересечения с ближайшими линиями диаграммы. Точки пересечения укажут, какие фазы находятся в равновесии у данного сплава при t1 : m – соответствует жидкому раствору, n – твердому раствору α. По проекциям точек пересечения на ось концентрации определяют химические составы равновесных фаз: в жидкой фазе содержится оm'% Ni (остальное – Сu); в α-фазе - оn' % Ni (остальное – Сu).
Количественное соотношение равновесных фаз определяют по отрезкам: количество жидкой фазы пропорционально кn, аα-фазы -mk . Линию mn называют конодой.
При охлаждении сплава из жидкого состояния ниже точки 1, лежа-щей на линии ликвидус, начинается кристаллизация. При переходе через точку 2 на линии солидус кристаллизация заканчивается. В про-цессе кристаллизации концентрация компонентов в жидком растворе изменяется согласно ликвидусу от точки 1 до точки 2', а в растворе α –согласно солидусу от точки 1' до точки 2.
После окончания кристаллизации структура сплава состоит из зерен твердого раствора α,имеющих одинаковый состав. Поскольку сплав был выбран произвольно, то рассуждения о формировании его структуры применимы к любому сплаву этой системы, кроме чистых Cu и Ni.
Диаграмма состояния системы «свинец – сурьма»
Диаграмма состояния данного типа характеризуется тем, что компоненты, неограниченно растворимые друг в друге в жидком состоянии, лишь ограниченно растворимы в твердом состоянии и образуют эвтектику (рис. 3).
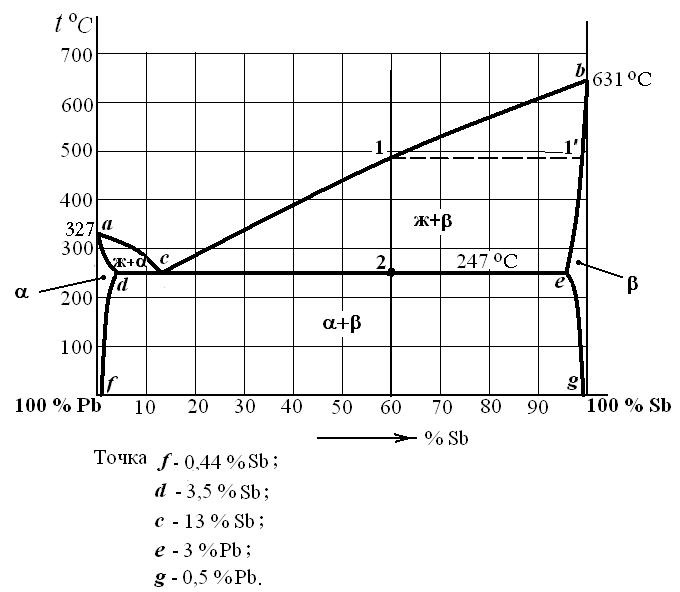
Рис. 3. Диаграмма состояния системы «свинец-сурьма».
Ликвидус состоит из двух ветвей – ac и cb. Ниже ас начинается кристаллизация твердого раствора α(твердый раствор замещения Sb в Pb), а ниже линии cb– кристаллизация твердого раствора β (твер-дый раствор замещения Pb в Sb).
Солидус состоит из трех участков: ad, bc и dce. Ниже линии ad завершается кристаллизация твердого раствора α, ниже линии be завершается кристаллизация твердого раствора β. На линии dce имеет место эвтектическое равновесие:
Жс ↔ αd + βe . (1)
Все сплавы, лежащие в пределах линии dce, будут в последней стадии кристаллизации затвердевать, образуя согласно реакции (формула 1) смесь фаз αd + βe , которую называют эвтектикой, а такую кристаллизацию – эвтектической. Эвтектическая кристалл-лизация происходит при постоянной температуре. При этом жидкий раствор имеет определенный (эвтектический) состав (точка с).
В сплавах, лежащих в пределах участка dc (доэвтектических), эвтектической кристаллизации предшествует образование твердого раствора α,а в сплавах, лежащих в пределах участка се (заэвтектических), эвтектической кристаллизации предшествует образование твердого раствораβ. После завершения кристаллизации структура до-эвтектических сплавов будет состоять из кристаллов твердого раствора α и эвтектики, структура заэвтектических сплавов – из кристаллов твердого раствораβ и эвтектики, структура эвтектического сплава содержит только эвтектику.
Линии df и eg называют линиями предельной растворимости (сольвусом): df определяет предельные концентрации Sb, которые могут раствориться в Pb при различных температурах; eg – предельные концентрации Pb, которые могут раствориться в Sb. Согласно наклону линий предельной растворимости, последняя с понижением температуры уменьшается.
В качестве примера рассмотрим процессы, происходящие при формировании структуры заэвтектического сплава «60 % Sb – 40 % Pb» (см. рис. 3).

Рис. 4. Кривая охлаждения сплава «40 % Pb + 40 % Sb».
При охлаждении из жидкого состояния (рис. 4) ниже точки 1 на-чинается кристаллизация твердого раствораβ. В процессе крис-таллизации в интервале температур, соответствующих точкам 1 и 2, согласно правилу отрезков, состав жидкого раствора изменяется по линии ликвидус от точки 1 до точки e, а составβ-фазы по линии солидус от точки 1' до точки с. К моменту достижения температуры точки 2 в сплаве будут кристаллы твердого раствораβ и жидкий раствор, имеющий состав точки с. Этот жидкий раствор при температуре ниже точки 2 закристаллизуется, образуя эвтектическую смесьЖс → αd + βe . После завершения кристаллизации сплав будет состоять из двух структурных составляющих: кристаллов твердого раствораβ и эвтектикиβ +(α+β).
3.3. Определение по микроструктуре химического состава сплава
В сплавах, содержащих две структурные составляющие, по их мик-роструктуре можно определить химический состав. Например, определим химический состав доэвтектического сплава состава Х (см. рис. 3). Весовое количество Sb в этом сплаве равно сумме его весовых количеств в первичных кристаллахα и эвтектике. Относи-тельное количество первичных кристаллов α и эвтектики можно определить по структуре сплава. Пусть Fα – относительная доля пло-щади шлифа, занимаемая первичными кристалламиα, Fэвт. – занимае-мая эвтектикой. Тогда, пренебрегая разностью удельных весовα и эвтектики, можно считать, что отношение Fα / Fэвт равно отношению весовых количеств этих структурных составляющих и, следовательно,
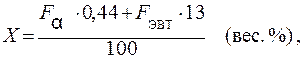
где 0,44 – содержание Sb в α-фазе, % ; 13 – содержание Sb в эвтек-тике, % .
Микроструктура сплавов выявлена травлением шлифов трави-телем состава 4 % HNO3 + 96 % С2Н5ОН. При наблюдении и изобра-жении структур сплавов системы «Pb – Sb» необходимо иметь в виду, чтоα - фаза темная,β - фаза светлая, эвтектика – однородная смесь темной составляющейα с небольшим количеством светлых вклю-чений β –фазы.
- Содержание отчета
Отчет должен содержать:
1) название работы;
2) цель работы;
3) сведения из теоретической части:
- об использовании правила отрезков для определения фазового состояния, химического состава фаз и относительного количества фаз;
- о методике определения химического состава сплава по мик-роструктуре;
4) диаграмму состояния системы «Cu – Ni»; кривые охлаждения чистой меди и сплава «80 % Cu - 20 % Ni» , построенные по диа-грамме состояния с указанием фазовых превращений; схемы структур чистой меди и сплава «80 % Cu - 20 % Ni» ;
5) диаграмму состояния системы «Pb – Sb»; кривые охлаждения доэвтектического, эвтектического и заэвтектического сплавов, построенные по диаграмме состояния с указанием фазовых превращений; схемы структур сплавов доэвтектического, эвтектического и заэвтектического; определение химического состава сплавов;
6) выводы; в них необходимо указать на особенности взаимодействия компонентов в обеих системах и изменения структуры сплавов системы «Pb - Sb» в зависимости от состава.
- Контрольные вопросы
1. Чем отличается твердый раствор замещения от твердого раствора внедрения?
2. Как изменение состава сплавов в системе «Cu - Ni» влияет на их структуру?
3. Как происходит образование эвтектики в системе «Pb – Sb»?
4. Почему при затвердевании жидкого раствора состава точки е в системе «Pb – Sb» образуется смесь двух твердых фаз?
- Библиографический список
1. Арзамасов Б. Н. и др. Материаловедение. - М: Изд-во МГТУ им. Н. Э. Баумана, 2004. – 648 с.
2. Солнцев Ю. П., Пряхин Е. И. Материаловедение. – СПб.: ХИМИЗДАТ, 2004. – 736 с.
