Лабораторная работа № 3 АРЕНЫ
Лабораторная работа № 1
ЭЛЕМЕНТНЫЙ АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Цель работы: определить качественный состав органического вещества.
Реактивы и материалы: неизвестное органическое вещество; оксид меди (II); безводный сульфат меди (II); известковая (или баритовая) вода; металлический натрий; 10%-ный раствор нитрата свинца; 2 н раствор гидроксида натрия; 0,5 н раствор нитропруссида натрия (Na2[Fe(CN)5NO] • 2Н20); сульфат железа (II); 1%-ный раствор хлорида (или сульфата) железа (III); концентрированная азотная кислота; 0,2 н раствор нитрата серебра; хлороформ; 1%-ный раствор перманганата калия; соляная кислота (1:3).
Оборудование: часовое стекло, пробирки, пробиркодержатель, газоотводная трубка с пробкой, кусочек ваты, спиртовка, стеклянная лопатка, скальпель, фильтровальная бумага, стеклянная воронка, фарфоровая ступка, пестик, медная проволока.
Опыт 1. Определение углерода и водорода
Получите у лаборанта или преподавателя вещество для анализа, запишите в рабочий журнал номер образца.
Около 100 мг (две стеклянные лопатки) испытуемого твердого или 10-12 капель жидкого вещества хорошо перемешивают с 200 мг (четыре стеклянные лопатки) порошка оксида меди (II) на часовом стекле и помещают в сухую пробирку. Помещают в пробирку вату (см. рис. 2) и насыпают на нее немного безводного сульфата меди. Закрывают пробирку пробкой с газоотводной трубкой.
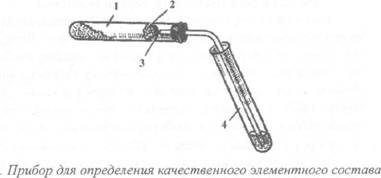
(углерод, водород) органического соединения: 1 - смесь органического вещества с оксидом меди (II); 2 - вата;
3 - безводный сульфат меди (II); 4 - приемная пробирка с известковой водой
Проверяют прибор на герметичность. Пробирку (1) закрепляют в пробиркодержателе в горизонтальном положении, а конец газоотводной трубки вводят до дна в другую пробирку (4), содержащую 2-3 мл (высота 2-3 см) известковой (или баритовой) воды. Смесь нагревают сначала осторожно, затем сильнее в течение 3-5 минут. После завершения опыта сначала вынимают конец газоотводной трубки из пробирки (4) и только после этого прекращают нагревание.
Вопросы и задания
Опишите наблюдения.
Как проверить прибор на герметичность?
Во что превращается оксид меди (II) и какие наблюдения это подтверждают? Напишите уравнение реакции. Почему для окисления веществ, содержащих углерод и водород, в качестве окислителя используется СиО (оксид меди), а не оксид другого металла?
Почему изменяется цвет сульфата меди? О содержании какого элемента в исследуемом веществе это свидетельствует? Напишите уравнение реакции.
Что происходит с известковой (или баритовой) водой? Наличие какого элемента в исследуемом веществе это доказывает? Почему при продолжительном пропускании оксида углерода (IV) через известковую воду образовавшийся осадок растворяется? Напишите уравнения реакций.
Опыт 2. Определение азота, серы и галогенов
Опыт проводят в вытяжном шкафу! Несколько кристаллов или капель исследуемого вещества помещают в сухую пробирку, держа ее наклонно, почти горизонтально, и кладут на середину пробирки кусочек очищенного от корки и высушенного фильтровальной бумагой металлического натрия величиной с четверть горошины. Держа пробирку в пробиркодержателе, сначала нагревают натрий до его расплавления, затем поворачивают пробирку вертикально, чтобы капля горячего натрия скатилась на вещество. (Осторожно, вспышка!)
После чего нагревают смесь до красного каления. Конец горячей пробирки резко опускают в фарфоровую ступку с 3 мл дистиллированной воды так, чтобы она растрескалась и разбилась и ее содержимое перешло в воду. (Осторожно, может быть вспышка или легкий взрыв от не до конца прореагировавшего металлического натрия. Поэтому данную операцию следует проводить в вытяжном шкафу с опущенной створкой или же работать в защитных очках или маске!)
Черные кусочки сплава хорошо измельчают пестиком, переливают содержимое ступки в пробирку, нагревают до кипения, отфильтровывают щелочную жидкость от кусочков угля и стекла через маленький складчатый фильтр. Фильтрат делят на три части для дальнейшего определения серы, азота и галогенов. Жидкость при этом должна быть бесцветной; желтая или коричневая окраска жидкости указывает на неполное разрушение исходного вещества. В этом случае опыт надо повторять с новой порцией вещества.
Вопросы и задания
Какие продукты могут получиться при сплавлении органического вещества с металлическим натрием? Составьте схему реакции.
Опыт 3. Пробы на серу
1. К 1 мл раствора нитрата свинца приливают раствор гидрокси- да натрия по каплям до растворения первоначально образующегося гидроксида свинца и затем добавляют несколько капель из первой части фильтрата (щелочной жидкости, полученной в первом опыте). Появление темно-коричневой окраски или образование черного осадка, ускоряющееся при нагревании, указывает на то, что исследуемое вещество содержало серу. 2. Для подтверждения вывода, сделанного после первой части опыта, проводят реакцию с нитропруссидом натрия. Для этого к 1 мл фильтрата добавляют 1-2 капли раствора нитропруссида натрия. При наличии иона S2' (серы)смесь сразу или постепенно приобретает ярко- фиолетовую окраску.
Вопросы и задания
О чем свидетельствует выпадение осадка (какого?) при взаимодействии с нитратом свинца? Напишите ионное уравнение реакции.
Что показывает реакция с нитропруссидом натрия?
Опыт 4. Проба на азот
Ко второй части фильтрата добавляют маленький кристаллик сульфата железа (II), кипятят смесь в течение 1-2 мин. Вносят каплю раствора FeCl3 (хлорида железа), охлаждают, дают постоять 3-5 минут и подкисляют разбавленной соляной кислотой (5-6 капель). Образование синего осадка "берлинской лазури" указывает, что исходное вещество содержит азот. Если азота мало, то раствор после подкисления окрашивается в зеленый цвет, а синий осадок выделяется лишь спустя некоторое время.
При положительной пробе на азот напишите ионное уравнение реакции образования "берлинской лазури".
Опыт 5. Проба на галогены
Третью часть фильтрата подкисляют концентрированной азотной кислотой. В случае наличия серы или азота этот кислый раствор кипятят в течение нескольких минут в вытяжном шкафу для окисления и удаления сероводорода и синильной кислоты, которые мешают последующей реакции. Остывший раствор делят на две части. К одной части добавляют несколько капель раствора нитрата серебра. Образование тяжелого хлопьевидного осадка указывает на присутствие галогена. Хлорид серебра - белый (затем темнеющий на свету), бромид - желтоватый, а йодид - желтый осадок. Для уточнения, присутствуют ли ионы брома или йода, к оставшейся части кислого раствора добавляют 1 мл хлороформа (или бензола) и затем при встряхивании 2-3 капли раствора перманганата калия. Когда смесь отстоится, отмечают окраску органического слоя. Фиолетовая окраска указывает на присутствие йода, оранжевая или желтая - брома. Однако избыток перманганата калия может обусловить фиолетовую окраску водного слоя, что не следует принимать за положительную реакцию на присутствие йода.
Вопросы и задания
Напишите ионное уравнение реакции образования галогенида серебра.
Опыт 6. Проба Бейльштейна на галогены
Медную проволоку диаметром 1-2 мм с петлей на конце прокаливают в бесцветной части пламени спиртовки до прекращения окрашивания пламени. После охлаждения проволоки петлю опускают в раствор или набирают несколько крупинок исследуемого вещества и вносят в пламя спиртовки. В присутствии галогенов появляется окраска пламени вследствие образования летучих галогенидов меди. Для очистки проволоку смачивают соляной кислотой и снова прокаливают. Следует сделать контрольный опыт, опуская проволоку в заведомо не содержащую галоген жидкость (дистиллированную воду, спирт).
Вопросы и задания
Почему при прокаливании медная проволока темнеет?
Какая окраска пламени свидетельствует о наличии галогенов?
В выводе укажите, в чем заключается принцип проведения качественного анализа органических соединений. На основании каких проб вы делаете вывод об элементном составе выданного вещества?
Лабораторная работа № 2
АЛКАНЫ, АЛКЕНЫ И АЛКИНЫ
Цель работы: познакомиться с лабораторными способами получения некоторых представителей гомологических рядов предельных, этиленовых и ацетиленовых углеводородов и изучить их свойства. Сравнить реакционную способность алканов, алкенов и алкинов.
Реактивы и материалы: обезвоженный ацетат натрия; натронная известь (смесь порошков оксида кальция с гидроксидом натрия 3:1); насыщенный раствор бромной воды; 1%-ный раствор перманга- ната калия; 5%-ный раствор брома в четыреххлористом углероде; концентрированные кислоты: соляная, серная, азотная; концентрированный раствор аммиака; 1 н раствор карбоната натрия; 0,2 н раствор нитрата серебра; аммиачный раствор хлорида меди (I); 1%-ный спиртовой раствор фенолфталеина; лакмусовая бумага синяя; пентан (гек- сан, гептан); жидкий непредельный углеводород; керосин; жидкий ацетиленовый углеводород (фенилацетилен); битое стекло.
Оборудование: ступка, пестик, газоотводная трубка с пробкой, стеклянная лопатка, набор пробирок в штативе, спиртовка.
Опыт 1. Получение метана. Изучение свойств метана
В ступке тщательно растирают обезвоженный ацетат натрия с натронной известью (весовое соотношение 1:2). Смесь помещают в пробирку (высота слоя 6-8 мм), закрывают пробкой с газоотводной трубкой и закрепляют в пробиркодержателе. В одну пробирку наливают 2-3 мл раствора перманганата калия и подкисляют 1-2 каплями концентрированной серной кислоты, в другую пробирку - 2 мл бромной воды. Смесь в пробирке нагревают в пламени спиртовки и конец газоотводной трубки поочередно вносят в растворы перманганата калия и бромной воды. Пропускание газа проводят в течение 20-30 с. После этого газоотводную трубку переворачивают вверх и поджигают газ у конца газоотводной трубки. После охлаждения пробирки к содержимому добавляют несколько капель концентрированной соляной кислоты.
Вопросы и задания
1. Почему используется безводный ацетат натрия? Зачем необходима натронная известь? Составьте уравнение реакции получения метана. Как изменяется окраска растворов перманганата калия и бромной воды при пропускании через них метана? К какому гомологическому ряду относится метан?
Каков цвет пламени при горении метана? Почему? Напишите уравнение реакции горения.
Для чего проделывают последний опыт? Опишите наблюдаемые явления и составьте уравнение реакции.
Опыт 2. Получение и изучение свойств этилена
В сухую колбу (пробирку) помещают несколько крупинок битого стекла, наливают 5 мл этанола и осторожно 15 мл концентрированной серной кислоты, закрывают пробкой с газоотводной трубкой. Смесь осторожно нагревают, не допуская сильных толчков реакционной смеси. Так же, как в опыте 1, изучают взаимодействие газа с раствором перманганата калия и бромной водой, горение этилена на воздухе.
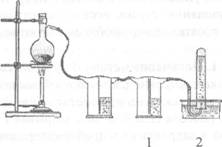
Рис. 2. Получение этилена и пропускание его через растворы перманганата калия (1) и бромной воды (2)
Вопросы и задания
В каком качестве используется битое стекло при получении этилена?
Какова роль концентрированной серной кислоты в реакции получения этилена? Ответ подтвердите уравнениями реакций.
Как изменяется окраска растворов перманганата калия и бромной воды при пропускании через них этилена? К какому гомологическому ряду относится этилен? Напишите уравнения проведенных реакций.
Каков цвет пламени при горении этилена? Почему? Напишите
уравнение реакции горения.
Опыт 3. Получение ацетилена. Изучение свойств ацетилена
Ацетилен получают в пробирке с газоотводной трубкой действием на кусочек карбида кальция водой. Полученный ацетилен пропускают через заранее приготовленные растворы: подкисленного серной кислотой раствора перманганата калия, бромной воды, аммиачного раствора хлорида меди (I) и раствора гидроксида диамминсе- ребра (I). Для приготовления последнего в пробирку вносят две капли раствора нитрата серебра и несколько капель концентрированного раствора аммиака (до исчезновения вначале образующегося осадка оксида серебра (I)). Так же, как и в предыдущих опытах, изучают горение ацетилена на воздухе. После проведения опыта в пробирку, в которой получали ацетилен, добавляют каплю фенолфталеина.
Вопросы и задания
· Составьте уравнение реакции получения ацетилена с использованием структурных формул.
· Объясните обесцвечивание раствора перманганата калия при пропускании ацетилена. Составьте и уравняйте методом электронного баланса (или методом полуреакций) уравнение окислительно-восстановительной реакции, принимая, что конечными продуктами являются оксид углерода (IV), сульфат марганца (II), сульфат калия и вода.
· Объясните, почему происходит обесцвечивание бромной воды при пропускании ацетилена. Напишите уравнение реакции.
· Отметьте изменения, происходящие при взаимодействии ацетилена с аммиачными растворами хлорида меди (I) и гидроксидом диамминсеребра (I). Какие алкины не могут вступать в реакции с данными реагентами? Как еще называют раствор гидроксида диамминсеребра (I)?
· Что вы наблюдали при горении ацетилена? Объясните. Напишите уравнение реакции горения ацетилена на воздухе.
· Какие наблюдения вы отметили после добавления в пробирку для получения ацетилена индикатора? Почему?
Опыт 4. Изучение действия концентрированных серной и азотной кислот на предельные и этиленовые углеводороды
По 1 мл в одну пробирку наливают алкан, в другую - алкен. Параллельно проводят опыты сравнения: добавляют по четыре капли концентрированной кислоты (серной или азотной) в каждую пробирку. Смесь встряхивают в течение 1-2 мин. О протекании реакции судят по следующим признакам: разогреванию смеси, исчезновению слоя углеводорода, изменению окраски.
Вопросы и задания
Напишите соответствующие уравнения реакций. Отметьте скорость протекания реакции алкена с концентрированной серной кислотой.
Опыт 5. Отношение жидких алканов и алкенов к окислителям
К 1 мл жидкого алкана добавляют 0,5 мл раствора перманганата калия. Содержимое пробирки встряхивают в течение минуты. То же проделывают с жидким алкеном.
Вопросы и задания
Отметьте наблюдаемые изменения. Напишите соответствующие уравнения реакций.
В выводе отразите ответы на следующие вопросы.
Как изменяется агрегатное состояние алканов и алкенов в гомологическом ряду?
Какие из изученных классов соединений химически более активны?
Какие реакции характерны для предельных и непредельных углеводородов?
Расположите в ряд С-Н кислотности алканы, алкены и алкины.
Почему в ряду соединений метан, этен, этин при их горении пламя становится более коптящим?
Сделайте выводы об отношении углеводородов к концентрированным кислотам.
Охарактеризуйте отношение алканов и алкенов к брому и окислителям.
Лабораторная работа № 7
Лабораторная работа № 8
УГЛЕВОДЫ. ПОЛИСАХАРИДЫ
Цель работы: доказать строение альдоз и кетоз - провести качественные реакции. Изучить кислотный гидролиз ди- и полисахаридов.
Реактивы и материалы: 5%-ные растворы глюкозы, фруктозы, лактозы и сахарозы; концентрированные и 2 н растворы соляной и серной кислот; 10%-ный раствор гидроксида натрия; концентрированный раствор аммиака; 0,2 н раствор нитрата серебра; 10%-ные растворы хлорида кальция и сульфата меди (II); 1%-ный раствор крахмала; раствор йода в йодистом калии; вата (или фильтровальная бумага).
Оборудование: фарфоровая ступка с пестиком, набор пробирок, два стакана (100 мл), асбестовая сетка, спиртовка, плитка.
Опыт 1. Доказательство наличия гидроксо-групп в моно- и дисахаридах
К 1 мл раствора хлорида кальция добавляют 0,5 мл раствора гидроксида натрия и приливают раствор глюкозы до растворения первоначально образовавшегося осадка. Содержимое пробирки взбалтывают. В пробирке смешивают 1 мл раствора глюкозы, 1 мл раствора гидроксида натрия и две капли раствора сульфата меди (II). Содержимое пробирки взбалтывают. Аналогичные опыты проводят с раствором фруктозы, сахарозы и лактозы. Полученные растворы сахаратов меди оставляют для следующего опыта.
Вопросы и задания
Составьте уравнение образования сахарата кальция.
Что наблюдаете при взаимодействии гидроксида меди (И) с сахаридами? Напишите соответствующие уравнения реакций.
Можно ли данные реакции отнести к качественным на сахара?
Опыт 2. Окисление моно- и дисахаридов
К полученным в опыте 1 щелочным растворам сахаратов меди добавляют по 0,5 мл воды, встряхивают содержимое пробирок и осторожно нагревают верхнюю часть пробирок, не доводя до кипячения. Помещают в чистую обезжиренную пробирку одну каплю раствора нитрата серебра, добавляют в нее две капли раствора гидроксида натрия и по каплям (3-4 капли) раствора аммиака до растворения образующегося осадка оксида серебра (I). В полученный раствор вносят одну каплю раствора глюкозы и осторожно нагревают пробирку без кипячения до начала побурения раствора. Аналогичные опыты с гидроксидом диамминсеребра (I) проводят и с другими углеводами: фруктозой, сахарозой и лактозой.
Вопросы и задания
Что происходит при нагревании сахаратов меди? Напишите уравнения реакций. У каких растворов изменений не наблюдается? Почему?
У каких углеводов отсутствует положительная реакция «серебряного зеркала» и почему?
Какие из углеводов можно назвать восстанавливающими, а какие невосстанавливающими? Какую функциональную группу определяют данной реакцией?
Опыт 3. Реакция Селиванова на фруктозу
В пробирку помещают крупинку сухого резорцина, две капли концентрированной соляной кислоты и 1 мл раствора фруктозы. Жидкость осторожно нагревают до начала кипения. Постепенно появляется красное окрашивание. При длительном кипячении проводят данную реакцию с глюкозой и сахарозой.
Вопросы и задания
Что образуется при взаимодействии реактива Селиванова с фруктозой?
Можно ли данную реакцию использовать как качественную на кетозы?
Почему при длительном кипячении возможна слабая положительная реакция с глюкозой и сахарозой?
Опыт 4. Изучение гидролиза сахарозы
В пробирке смешивают 0,5 мл раствора сахарозы, две капли раствора соляной кислоты и 0,5 мл воды. Смесь осторожно нагревают в пламени спиртовки в течение 30 секунд, не допуская выброса раствора из пробирки. Смесь делят на две пробирки. Первую часть раствора нейтрализуют по каплям раствором гидроксида натрия и добавляют 0,5 мл раствора сульфата меди (II). Верхнюю часть пробирки осторожно нагревают до кипения. Ко второй части гидролизата добавляют крупинку резорцина и 2-3 капли концентрированной соляной кислоты. Нагревают до кипения. Для сравнения проводят холостой опыт. Водный раствор сахарозы кипятят без добавления соляной кислоты и проводят реакцию с гидроксидом меди (II) и Селиванова.
Вопросы и задания
Что доказывает реакция с гидроксидом меди (II)? Положительна ли реакция Селиванова?
Объясните результаты проведения опыта без добавления соляной кислоты.
Опыт 5. Кислотный гидролиз крахмала
В пробирку наливают 2 мл крахмального клейстера и добавляют 2 мл раствора серной кислоты. Смесь нагревают до кипения и через равные промежутки времени (две минуты) пипеткой отбирают пробы раствора (по 0,5 мл) в 5-6 пробирок. В охлажденные пробы добавляют по 1-2 капли раствора йода в йодистом калии. Нагревание раствора прекращают, когда проба раствора с йодом становится слабо-желтой (не изменяет цвета). После охлаждения с гидролизатом проводят качественную реакцию на глюкозу так же, как в опыте 4.
Вопросы и задания
Что образуется при добавлении йода к крахмалу? Составьте схему взаимодействия.
По какой схеме гидролизуется крахмал? Изменяют ли продукты гидролиза окраску раствора йода?
Приведите формулу мальтозы и уравнение ее гидролиза. Обладает ли мальтоза восстанавливающими свойствами?
Опыт 6. Гидролиз целлюлозы
В фарфоровую ступку помещают небольшой кусочек ваты (или фильтровальной бумаги), приливают 0,5 мл концентрированной серной кислоты и растирают вату (бумагу) пестиком до получения густой кашицы. Если необходимо, добавляют еще несколько капель кислоты. В ступку наливают 10-15 мл воды, растворяют в ней кашицу и выливают раствор в стаканчик. Полученный раствор кипятят около 10 минут. Гидролизат проверяют на присутствие глюкозы - реакция с гидроксидом меди (II).
Вопросы и задания
Приведите строение целлюлозы и составьте схему гидролиза целлюлозы.
Обладает ли целлюлоза восстанавливающими свойствами?
В общем выводе о работе ответьте на следующие вопросы.
Почему возникло название класса "углеводы"? На какие группы они делятся?
Какие функциональные группы входят в состав углеводов? Как это доказать?
Какими свойствами отличаются моно-, ди- и полисахариды?
Какие продукты обнаруживаются при гидролизе сахарозы, крахмала, целлюлозы? Какой вывод можно сделать о строении данных соединений?
Лабораторная работа № 9
АМИНЫ. ДИАЗОСОЕДИНЕНИЯ
Цель работы: изучить некоторые физические и химические свойства алифатических и ароматических аминов. Отметить их характерные свойства. Получить диазосоединения и оценить область их применения.
Реактивы и материалы: ацетамид; ангидрид уксусной кислоты; нитробензол; анлин; нафтол; бромная вода; концентрированная соляная кислота; 2 н раствор серной кислоты; концентрированный и 2 н растворы гидроксида натрия; хромовая смесь; олово; 20%-ный раствор нитрита натрия; 1%-ный раствор хлорида железа (III); красная лакмусовая бумага; йодкрахмальная бумага; 1%-ный спиртовой раствор фенолфталеина; лед.
Оборудование: набор пробирок, пробка с газоотводной трубкой, стеклянная палочка, спиртовка, водяная баня, плитка.
Опыт 1. Получение метиламина из ацетамида и изучение его некоторых свойств
В пробирку помещают шпатель ацетамида и 0,5 мл бромной воды. (Опыт проводят в вытяжном шкафу!) После охлаждения водой к смеси приливают по каплям концентрированный раствор гидроксида натрия до обесцвечивания брома и добавляют еще 2-3 капли разбавленного раствора щелочи. Пробирку закрывают пробкой с газоотводной трубкой, помещенной в охлаждаемую льдом пробирку с водой. Нагревают содержимое на пламени спиртовки. К отверстию газоотводной трубки подносят стеклянную палочку, смоченную концентрированной соляной кислотой.
С помощью красной лакмусовой бумаги (или раствора фенолфталеина) проверяют реакцию среды в полученном водном растворе метиламина.
Вопросы и задания
По каким признакам можно доказать наличие полученного метиламина? Составьте уравнение реакции.
Что наблюдаете при поднесении соляной кислоты к отверстию газоотводной трубки? Какое вещество образуется? Напишите уравнение реакции. 3. Напишите реакцию взаимодействия метиламина с водой. Какова среда полученного раствора?
Опыт 2. Получение анилина из нитробензола
В пробирку помещают маленький кусочек олова, 0,5 мл концентрированной соляной кислоты и каплю нитробензола. Бурно протекающая реакция ослабевает через несколько минут. Если реакция замедляется, то смесь подогревают на пламени спиртовки. Реакцию ведут до тех пор, пока все олово не прореагирует. Для этого может понадобиться еще 2-3 капли соляной кислоты. После охлаждения 0,5 мл полученного раствора приливают в пробирку с тремя каплями бромной воды.
Вопросы и задания
Является ли данная реакция окислительно-восстановительной? Составьте уравнения реакций. Чем является в этой реакции нитробензол? Кто впервые осуществил эту реакцию?
Укажите признак реакции анилина с бромной водой. Напишите уравнение реакции. К какому типу относится данная реакция? Можно ли эту реакцию использовать как качественную на анилин?
Сравните условия бромирования бензола и анилина и объясните полученные результаты.
Опыт 3. Получение солей анилина
В пробирке смешивают одну каплю анилина с 1 мл воды. Смесь взбалтывают. Красной лакмусовой бумажкой и раствором фенолфталеина проверяют реакцию среды в полученной эмульсии. Эмульсию разделяют на две части. К первой части эмульсии добавляют по каплям 0,5 мл раствора серной кислоты. К другой части эмульсии приливают по каплям концентрированную соляную кислоту до образования прозрачного раствора, после чего к полученному раствору приливают по каплям концентрированный раствор гидроксида натрия.
Вопросы и задания
Каким свойством обладает анилин? Объясните различное отношение к индикаторам растворов метиламина и анилина.
Каков эффект наблюдается при добавлении серной и соляной кислот к анилину? Напишите уравнения реакций и назовите продукты. К какому типу относится данная реакция?
Возможна ли реакция со слабыми кислотами? Почему?
Что наблюдаете при прибавлении к соли раствора щелочи? Напишите реакцию разложения соли анилина.
Опыт 4. Получение ацетанилида
(Опыт проводят в вытяжном шкафу!) В пробирку наливают 0,5 мл анилина и добавляют по каплям столько же уксусного ангидрида. Содержимое пробирки тщательно встряхивают и охлаждают.
Вопросы и задания
По каким признакам судят о протекании реакции. Напишите уравнение реакции. К какому типу относится данная реакция?
Опыт 5. Окисление анилина
В пробирку наливают 1 мл анилина и прибавляют 1 мл хромовой смеси. Образование "черного анилина" является результатом глубокого окисления анилина.
Опишите наблюдаемые явления.
Опыт 6. Диазотирование анилина
В пробирку наливают 1 мл анилина, 0,5 мл концентрированной соляной кислоты и кусочек льда. Кроме этого, пробирку помещают в воду со льдом. В полученный раствор при встряхивании по каплям добавляют 0,5 мл охлажденного раствора нитрита натрия. Полноту диазотирования анилина проверяют йодкрахмальной бумажкой: если анилин продиазоти- рован полностью, то на бумаге появляется голубое или синее окрашивание, указывающее на присутствие в растворе свободной азотистой кислоты. Пробу производят через 2-3 минуты после прибавления нитрита натрия. Если индикаторная йодокрахмальная бумажка не синеет, добавляют еще 1-2 капли раствора нитрита натрия и вновь повторяют пробу. Полученный раствор диазосоединения оставляют для следующих опытов в охлаждаемой смеси (снег, лед) и делят на три части.
Вопросы и задания
Напишите уравнения соответствующих реакций. Назовите полученные продукты.
Почему диазосоединения получают при температуре около 0 °С?
Опыт 7. Разложение солей фенилдиазония (Опыт проводить в пробирке!) Третью часть раствора хлорида фенилдиазония, полученного в опыте 6, помещают в горячую водяную баню (50-60 °С) и нагревают до прекращения выделения пузырьков азота. На поверхности жидкости образуется темное маслянистое пятно с характерным запахом фенола. Для доказательства образования фенола добавляют каплю раствора хлорида железа (III).
Вопросы и задания
Составьте реакцию получения фенола. Оцените отношение солей диазония к нагреванию.
Опыт 8. Получение а-гидроксиазобензола
В пробирку помещают несколько кристаллов фенола, добавляют 2 мл раствора гидроксида натрия до полного растворения фенола. Полученный раствор приливают к 1/3 части раствора бензолдиазоний хлорида, полученного в опыте 6.
Вопросы и задания
Отметьте появившуюся окраску. Напишите схему реакции взаимодействия бензолдиазонийхлорида с феноксидом натрия. К какому типу относится данная реакция?
В какой среде протекает реакция азосочетания с фенолами?
Опыт 9. Получение кислотного азокрасителя (судан I)
В пробирке растворяют несколько кристаллов-нафтола в трех каплях раствора гидроксида натрия. К полученному раствору приливают 2-3 капли ранее полученного хлорида фенилдиазония.
Вопросы и задания
Опишите наблюдаемые явления. Составьте уравнение реакции. К какому типу относится данная реакция?
В общем выводе о работе ответьте на следующие вопросы.
Почему амины обладают основными свойствами?
Какие амины - алифатические или ароматические - обладают более основными свойствами? Сравните основность алифатических и ароматических аминов с основностью аммиака. Чем это обусловлено?
Какую реакцию можно считать качественной на анилин?
С какими группами соединений могут вступать соли диазония в реакции азосочетания? Какова область применения диазосоединений?
Почему азосоединения окрашены? Какие функциональные группы могут служить в качестве ауксохрома и хромофора?
Лабораторная работа № 1
ЭЛЕМЕНТНЫЙ АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Цель работы: определить качественный состав органического вещества.
Реактивы и материалы: неизвестное органическое вещество; оксид меди (II); безводный сульфат меди (II); известковая (или баритовая) вода; металлический натрий; 10%-ный раствор нитрата свинца; 2 н раствор гидроксида натрия; 0,5 н раствор нитропруссида натрия (Na2[Fe(CN)5NO] • 2Н20); сульфат железа (II); 1%-ный раствор хлорида (или сульфата) железа (III); концентрированная азотная кислота; 0,2 н раствор нитрата серебра; хлороформ; 1%-ный раствор перманганата калия; соляная кислота (1:3).
Оборудование: часовое стекло, пробирки, пробиркодержатель, газоотводная трубка с пробкой, кусочек ваты, спиртовка, стеклянная лопатка, скальпель, фильтровальная бумага, стеклянная воронка, фарфоровая ступка, пестик, медная проволока.
Опыт 1. Определение углерода и водорода
Получите у лаборанта или преподавателя вещество для анализа, запишите в рабочий журнал номер образца.
Около 100 мг (две стеклянные лопатки) испытуемого твердого или 10-12 капель жидкого вещества хорошо перемешивают с 200 мг (четыре стеклянные лопатки) порошка оксида меди (II) на часовом стекле и помещают в сухую пробирку. Помещают в пробирку вату (см. рис. 2) и насыпают на нее немного безводного сульфата меди. Закрывают пробирку пробкой с газоотводной трубкой.

(углерод, водород) органического соединения: 1 - смесь органического вещества с оксидом меди (II); 2 - вата;
3 - безводный сульфат меди (II); 4 - приемная пробирка с известковой водой
Проверяют прибор на герметичность. Пробирку (1) закрепляют в пробиркодержателе в горизонтальном положении, а конец газоотводной трубки вводят до дна в другую пробирку (4), содержащую 2-3 мл (высота 2-3 см) известковой (или баритовой) воды. Смесь нагревают сначала осторожно, затем сильнее в течение 3-5 минут. После завершения опыта сначала вынимают конец газоотводной трубки из пробирки (4) и только после этого прекращают нагревание.
Вопросы и задания
Опишите наблюдения.
Как проверить прибор на герметичность?
Во что превращается оксид меди (II) и какие наблюдения это подтверждают? Напишите уравнение реакции. Почему для окисления веществ, содержащих углерод и водород, в качестве окислителя используется СиО (оксид меди), а не оксид другого металла?
Почему изменяется цвет сульфата меди? О содержании какого элемента в исследуемом веществе это свидетельствует? Напишите уравнение реакции.
Что происходит с известковой (или баритовой) водой? Наличие какого элемента в исследуемом веществе это доказывает? Почему при продолжительном пропускании оксида углерода (IV) через известковую воду образовавшийся осадок растворяется? Напишите уравнения реакций.
Опыт 2. Определение азота, серы и галогенов
Опыт проводят в вытяжном шкафу! Несколько кристаллов или капель исследуемого вещества помещают в сухую пробирку, держа ее наклонно, почти горизонтально, и кладут на середину пробирки кусочек очищенного от корки и высушенного фильтровальной бумагой металлического натрия величиной с четверть горошины. Держа пробирку в пробиркодержателе, сначала нагревают натрий до его расплавления, затем поворачивают пробирку вертикально, чтобы капля горячего натрия скатилась на вещество. (Осторожно, вспышка!)
После чего нагревают смесь до красного каления. Конец горячей пробирки резко опускают в фарфоровую ступку с 3 мл дистиллированной воды так, чтобы она растрескалась и разбилась и ее содержимое перешло в воду. (Осторожно, может быть вспышка или легкий взрыв от не до конца прореагировавшего металлического натрия. Поэтому данную операцию следует проводить в вытяжном шкафу с опущенной створкой или же работать в защитных очках или маске!)
Черные кусочки сплава хорошо измельчают пестиком, переливают содержимое ступки в пробирку, нагревают до кипения, отфильтровывают щелочную жидкость от кусочков угля и стекла через маленький складчатый фильтр. Фильтрат делят на три части для дальнейшего определения серы, азота и галогенов. Жидкость при этом должна быть бесцветной; желтая или коричневая окраска жидкости указывает на неполное разрушение исходного вещества. В этом случае опыт надо повторять с новой порцией вещества.
Вопросы и задания
Какие продукты могут получиться при сплавлении органического вещества с металлическим натрием? Составьте схему реакции.
Опыт 3. Пробы на серу
1. К 1 мл раствора нитрата свинца приливают раствор гидрокси- да натрия по каплям до растворения первоначально образующегося гидроксида свинца и затем добавляют несколько капель из первой части фильтрата (щелочной жидкости, полученной в первом опыте). Появление темно-коричневой окраски или образование черного осадка, ускоряющееся при нагревании, указывает на то, что исследуемое вещество содержало серу. 2. Для подтверждения вывода, сделанного после первой части опыта, проводят реакцию с нитропруссидом натрия. Для этого к 1 мл фильтрата добавляют 1-2 капли раствора нитропруссида натрия. При наличии иона S2' (серы)смесь сразу или постепенно приобретает ярко- фиолетовую окраску.
Вопросы и задания
О чем свидетельствует выпадение осадка (какого?) при взаимодействии с нитратом свинца? Напишите ионное уравнение реакции.
Что показывает реакция с нитропруссидом натрия?
Опыт 4. Проба на азот
Ко второй части фильтрата добавляют маленький кристаллик сульфата железа (II), кипятят смесь в течение 1-2 мин. Вносят каплю раствора FeCl3 (хлорида железа), охлаждают, дают постоять 3-5 минут и подкисляют разбавленной соляной кислотой (5-6 капель). Образование синего осадка "берлинской лазури" указывает, что исходное вещество содержит азот. Если азота мало, то раствор после подкисления окрашивается в зеленый цвет, а синий осадок выделяется лишь спустя некоторое время.
При положительной пробе на азот напишите ионное уравнение реакции образования "берлинской лазури".
Опыт 5. Проба на галогены
Третью часть фильтрата подкисляют концентрированной азотной кислотой. В случае наличия серы или азота этот кислый раствор кипятят в течение нескольких минут в вытяжном шкафу для окисления и удаления сероводорода и синильной кислоты, которые мешают последующей реакции. Остывший раствор делят на две части. К одной части добавляют несколько капель раствора нитрата серебра. Образование тяжелого хлопьевидного осадка указывает на присутствие галогена. Хлорид серебра - белый (затем темнеющий на свету), бромид - желтоватый, а йодид - желтый осадок. Для уточнения, присутствуют ли ионы брома или йода, к оставшейся части кислого раствора добавляют 1 мл хлороформа (или бензола) и затем при встряхивании 2-3 капли раствора перманганата калия. Когда смесь отстоится, отмечают окраску органического слоя. Фиолетовая окраска указывает на присутствие йода, оранжевая или желтая - брома. Однако избыток перманганата калия может обусловить фиолетовую окраску водного слоя, что не следует принимать
