Пространственное строение и изомерия комплексных соединений
Одинаковыелиганды симметрично располагаются в пространстве вокруг центрального атома. Чаще всего встречаются четные координационные числа - 2, 4, 6. Им соответствуют следующие геометрические конфигурации:
| Координационное число | Геометрическая конфигурация | |
 | линейная | |
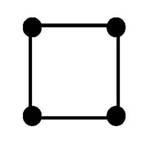 | плоская квадратная | |
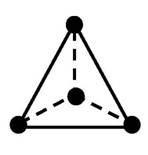 | тетраэдрическая | |
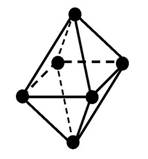 | октаэдрическая |
Для координационного числа 4 и тетраэдрической конфигурации все положения лигандов относительно центрального атома эквивалентны. Поэтому тетраэдрические комплексы типа [MA2B2] (где М - центральный атом, аА и В - лиганды) не имеют изомеров.
Комплексы платины (II), например [Pt(NH3)2Cl2], встречаются в двух изомерных формах, отличающихся по цвету, растворимости, дипольному моменту, реакционной способности и способам получения. В одном из изомеров этого комплекса атомы хлора разделены центральным атомом (транс-изомер), а в другом (цис-изомер) они находятся рядом друг с другом, по одну сторону от центрального атома (рис. 7.1).

Рис. 7.1. Пространственное строение изомера [Pt(NH3)2Cl2]: а – транс-изомер, б – цис-изомер
В случае комплексных соединений с координационным числом 6 лиганды должны быть симметрично расположены вокруг центрального иона, образуя фигуру правильного октаэдра (рис. 7.2).
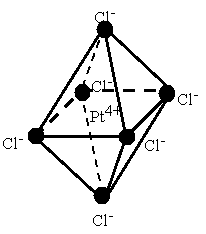
Рис. 7.2. Пространственное строение комплексного иона [PtCl6]2-
Если все координированные группы одинаковы, как показано на рисунке, то перестановка одной группы на место другой не изменит структуры комплекса. Но если группы не одинаковы, то возможно различное их расположение, вследствие чего могут образоваться изомеры. Например, соединение [Pt(NH3)2Cl4] существует в двух изомерных формах, отличающихся одна от другой по своей окраске и другим свойствам. Строение этих изомеров схематически показано на рис. 7.3. В одном случае молекулы NH3 помещаются у противоположных вершин октаэдра (транс-изомер), в другом - у соседних (цис-изомер).
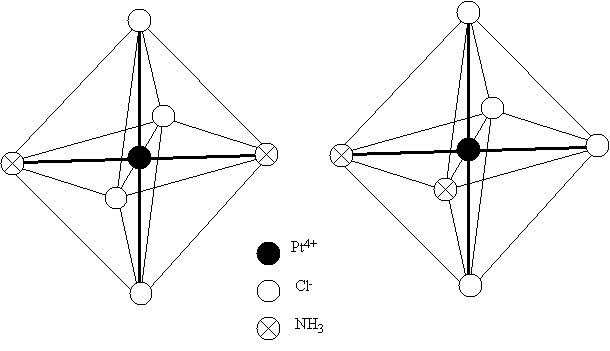
Рис. 7.3. Пространственное строение изомеров [Pt(NH3)2Cl4]:
а – транс-изомер, б – цис-изомер
К геометрической изомерии относится и зеркальная (оптическая) изомерия. Например, комплексы [СоЕn3]С13 и цис-[CoЕn2С12]С1 существуют в виде двух зеркальных антиподов:
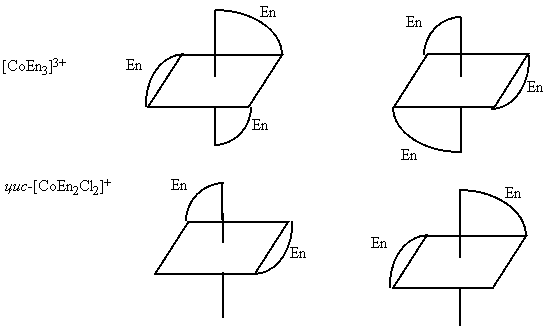
Кроме геометрической изомерии, известны и другие виды изомерии комплексных соединений, обусловленные различным положением и связью лигандов во внутренней сфере. Так, гидратная изомерия имеет место при переходе воды из внутренней сферы во внешнюю, например [Сr(Н2О)6]С13, [Сr(Н2О)5С1]С12·Н2О, [Сr(Н2О)4С12]С12·2Н2О. При этом цвет комплекса меняется от сине-фиолетового до светло-зеленого.
Ионизационная изомерия определяется различным распределением ионов между внутренней и внешней сферами, например: [Co(NH3)5Br]SO4, [Co(NH3)5SO4]Br; [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2.
Координационная изомерия связана с переходом лигандов от одного комплексообразователя к другому: [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6].
