Рецензенты: д-р хим. наук, проф. Л.М. Васильченко
УДК 546
Лабораторный практикум по общей химии: лаб. практикум. / Т.В. Губанова, Е.Г. Данилушкина, Н.И. Лисов, С.И. Тюменцева, О.В. Лаврентьева, А.В. Немков. – Самара: Самар. гос. техн. ун-т. 2009. – 96 с.
Лабораторный практикум разработан в соответствии с государственными образовательными стандартами высшего профессионального образования.
Практикум охватывает важнейшие теоретические разделы курса общей химии, методики анализа, правила безопасности, а так же, технику выполнения лабораторных работ, описание выполняемых опытов по всем разделам, включенным в программу, и рекомендации к их оформлению. В каждый раздел включены упражнения для самостоятельной работы и контрольные задачи. В приложении представлены таблицы стандартных величин, используемых в расчетах.
Лабораторный практикум предназначен для студентов первого курса нехимических специальностей дневной и вечерней форм обучения.
Ил. 21. Табл. 8. Библиогр.: 17 назв.
Коллектив авторов: Т.В. Губанова, Е.Г. Данилушкина, Н.И. Лисов,
С.И. Тюменцева,О.В. Лаврентьева, А.В. Немков
Рецензенты: д-р хим. наук, проф. Л.М. Васильченко
д-р хим. наук, проф. В.В. Слепушкин
| ISBN | ã Т.В. Губанова, Е.Г. Данилушкина, Н.И. Лисов, С.И. Тюменцева, О.В. Лаврентьева, А.В. Немков, 2009 ã Самарский государственный технический университет, 2009 |
Оглавление
Оглавление. 3
ПРЕДИСЛОВИЕ.. 4
ОБЩИЕ ПРАВИЛА РАБОТЫ В ЛАБОРАТОРИИ.. 5
1. ПРАВИЛА ВЫПОЛНЕНИЯ ЛАБОРАТОРНЫХ РАБОТ. 6
2. ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ.. 8
3. ХИМИЧЕСКАЯ ПОСУДА.. 12
4. ЛАБОРАТОРНОЕ ОБОРУДОВАНИЕ.. 16
5. ОСНОВНЫЕ ПРИЕМЫ РАБОТЫ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ.. 19
6. ТРЕБОВАНИЯ К ОФОРМЛЕНИЮ ОТЧЕТА ПО ЛАБОРАТОРНОЙ РАБОТЕ.. 25
Лабораторные работы по общей химии.. 27
Лабораторная работа № 1. 27
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.. 27
Лабораторная работа № 2. 30
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА МЕТАЛЛА.. 30
Лабораторная работа № 3. 33
ОКИСЛИТЕЛЬНО-ВОСТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.. 33
Лабораторная работа № 4. 35
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ.. 35
Лабораторная работа № 5. 39
ОПРЕДЕЛЕНИЕ ИЗМЕНЕНИЯ ЭНТАЛЬПИИ ХИМИЧЕСКИХ РЕАКЦИЙ.. 39
Лабораторная работа № 6. 46
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ.. 46
Лабораторная работа № 7. 50
ПРИГОТОВЛЕНИЕ РАСТВОРА КИСЛОТЫ... 50
Лабораторная работа № 8. 53
ОПРЕДЕЛЕНИЕ рН РАСТВОРОВ. ГИДРОЛИЗ СОЛЕЙ.. 53
Лабораторная работа № 9. 55
ЖЕСТКОСТЬ ВОДЫ... 55
Лабораторная работа № 10. 60
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ. 60
Лабораторная работа № 11. 62
ЭЛЕКТРОЛИЗ растворов.. 62
Лабораторная работа № 12. 65
КОРРОЗИЯ МЕТАЛЛОВ.. 65
Лабораторная работа № 13. 67
БЕРИЛЛИЙ. МАГНИЙ.. 67
Лабораторная работа № 14. 70
ЖЕЛЕЗО. КОБАЛЬТ. НИКЕЛЬ. 70
Лабораторная работа № 15. 73
БЕССТРУЖКОВЫЙ МЕТОД АНАЛИЗА СПЛАВОВ. 73
Лабораторная работа № 16. 75
ГАЛОГЕНЫ... 75
Лабораторная работа № 17. 79
МЕТОДЫ ПОЛУЧЕНИЯ КОЛЛОИДНЫХ СИСТЕМ... 79
Лабораторная работа № 18. 84
ПЕРЕГОНКА НЕФТИ ПОД АТМОСФЕРНЫМ ДАВЛЕНИЕМ... 84
Приложение.. 88
БИБЛИОГРАФИЧЕСКИЙ СПИСОК.. 95
ПРЕДИСЛОВИЕ
Предлагаемая книга представляет собой учебно-методическое руководство к практическим занятиям по курсу общей химии для студентов технических вузов. Практикум написан коллективом авторов на основе многолетнего опыта работы кафедры общей и неорганической химии Самарского государственного технического университета. Он охватывает практически все разделы общей и неорганической химии, предусмотренные Государственными Образовательными Стандартами и типовыми программами для нехимических специальностей, составленными на их основе. Практикум содержит два раздела и приложения.
Первый раздел содержит правила по технике безопасности работы в лаборатории. В этом же разделе приводятся многочисленные иллюстрации химической посуды и лабораторного оборудования, что позволяет правильно и грамотно использовать научную терминологию при описании работ.
Второй раздел содержит лабораторные работы по теоретическим основам химии. Здесь же рассматривается химия элементов по группам Периодической системы Д.И. Менделеева.
Описания лабораторных работ не содержат теоретической части, но в некоторых случаях в текст включены отдельные теоретические вопросы, когда без этого сущность выполняемого опыта может быть не до конца понятна студентам. После каждой лабораторной работы приводятся контрольные вопросы и задачи. Выполнение этих заданий, требующее серьезной работы с учебником, способствует углублению знаний студентов. Так комбинируя теоретические вопросы с набором опытов можно составлять индивидуальные задания, что должно стимулировать самостоятельность работы студентов. По усмотрению преподавателя вопросы и задачи по теории, а также предлагаемые в разделе по химии элементов цепочки превращений, могут быть использованы при проведении практических и семинарских занятий.
Проведение учебного химического эксперимента способствует формированию специальных навыков техники лабораторных работ по химии. Кроме того, студенты еще раз повторяют как физические и химические свойства конкретных соединений, так и общие свойства, и генетические связи тех классов неорганических веществ, с которыми работают.
В конце книги даны соответствующие приложения, содержащие справочные данные в виде таблиц, необходимые для составления отчетов и для ответов на теоретические вопросы и задачи.
ХИМИЧЕСКАЯ ПОСУДА
Для проведения опытов в химических лабораториях применяют посуду, изготовленную из тонкостенного или толстостенного стекла (рис. 6). Она должна быть инертна к химическому воздействию, устойчива к изменениям температуры. При проведении реакций при повышенных температурах используют посуду, изготовленную из молибденового (до 400 °С), пирексного (до 600 °С) или кварцевого (до 1500 °С) стекла.
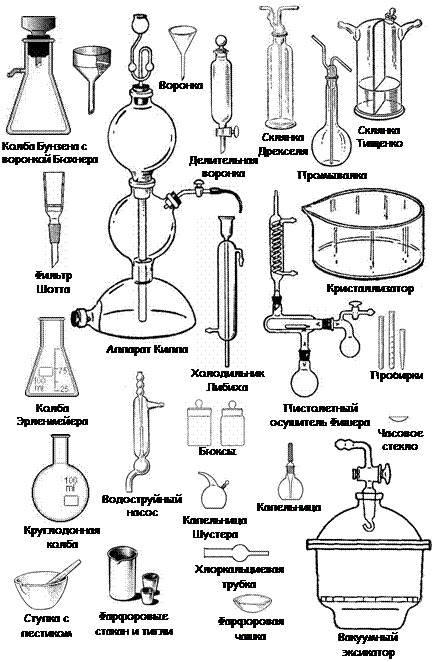
Рис. 6. Лабораторная посуда
Химическая посуда, применяемая в лаборатории, может быть условно разделена на ряд групп: общего назначения, мерная, специального назначения. На рис. 7 приведено вспомогательное лабораторное оборудование.

Рис. 7. Вспомогательное лабораторное оборудование.
Посуда общего назначения
К группе общего назначения относятся пробирки, воронки, стаканы, колбы.
Пробирки предназначены для проведения лабораторных работ и представляют собой сосуды цилиндрической формы с закругленным дном.
Воронки предназначены для переливания жидкостей и фильтрования.
Лабораторные стаканы представляют собой тонкостенные цилиндры различной емкости.
Колбы предназначены для проведения различных препаративных и аналитических работ. Они бывают круглодонные, плоскодонные, конические.
Мерная посуда
К этой группе относится посуда, употребляемая для грубого измерения объемов – цилиндры, мензурки, а также посуда для точного измерения определенных объемов мерные колбы, пипетки, бюретки (рис. 8).
Мерные цилиндры – сосуды цилиндрической формы с нанесенными на стенке делениями, указывающими объем в миллилитрах.
Мензурки – сосуды конической формы, на наружной поверхности которых, как и у мерных цилиндров, нанесены деления в миллилитрах.
Колбы мерные служат для приготовления растворов точной концентрации. Они имеют плоское дно и длинное узкое горло, на котором нанесена метка, указывающая уровень жидкости, при котором объем ее будет соответствовать указанному на колбе.
Пипетки предназначены для точного отмеривания определенного объема жидкости и представляют собой тонкую стеклянную трубку с оттянутым концом. На верхней части пипетки нанесена метка, соответствующая уровню жидкости, при котором объем ее будет соответствовать указанному на пипетке. Пипетки, рассчитанные на объем 5 -100 мл, имеют посредине расширение.
Бюретки применяют для отмеривания точных объемов жидкостей. Они представляют собой стеклянные трубки с нанесенными на них делениями. С их помощью можно измерять объемы жидкостей с точностью до 0,05 мл, а в микробюретках – до 0,005 мл.
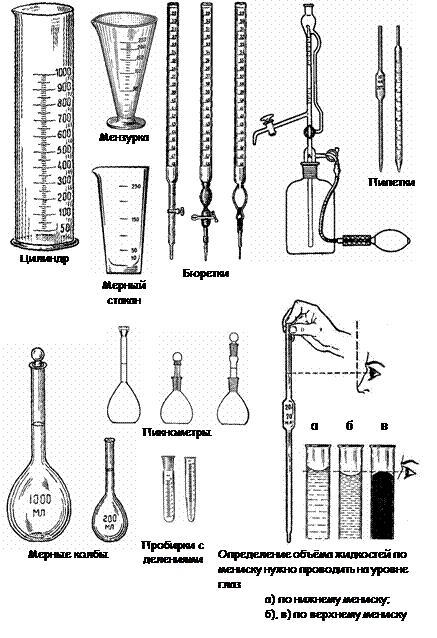
Рис. 8. Мерная посуда
Посуда из фарфора
Фарфоровые изделия по сравнению со стеклянными характеризуются большей химической и термической стойкостью. К ним можно отнести тигли, стаканы, чашки для выпаривания, ступки с пестиками, ложки, воронки Бюхнера.
Тигли применяют для сушки и прокаливания твердых веществ.
Стаканы применяют для растворения, перемешивания и нагревания жидкостей.
Кружки с ручками и с носиком используют для разливки и приготовления растворов кислот, щелочей.
Чашки применяют для выпаривания жидкости до сухого остатка.
Ступки с пестиками используют для тонкого измельчения небольшого количества твердого вещества или тщательного перемешивания нескольких твердых порошкообразных веществ.
Ложки служат для отбора веществ при взвешивании, для снятия осадков с фильтров.
Воронки Бюхнера применяют при фильтровании растворов в горячем или холодном состоянии с применением вакуума.
ЛАБОРАТОРНОЕ ОБОРУДОВАНИЕ
Нагревательные приборы
К числу нагревательных приборов, используемых при выполнении лабораторных работ, относятся газовые горелки, электрические плитки, сушильные шкафы, муфельные печи, бани (рис. 9).
Газовые горелки применяют двух типов – Бунзена и Теклю. Последняя наиболее удобна в обращении. Ее конструкция позволяет регулировать поток воздуха и газа. Подачу газа регулируют винтом, а воздуха – диском. При закрытом диске получают коптящее пламя. Отворачивая диск, увеличивают приток воздуха и получают голубоватое, прозрачное и несветящееся пламя. Горелки Бунзена имеют регулировочную муфту с отверстием. Поворачивая ее, можно закрыть или открыть отверстие, имеющееся в нижней части горелки, и тем самым регулировать приток воздуха.
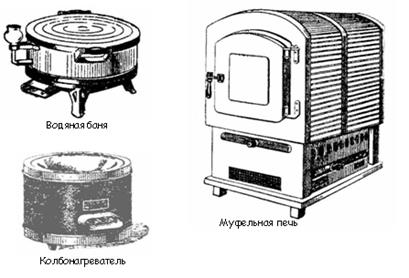
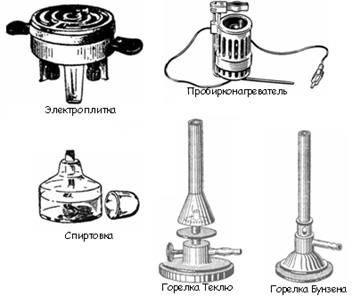
Рис. 9. Нагревательные приборы
Электрические плитки применяют двух типов: с открытым или за крытым нагревательным элементом. Плитки с открытым элементом – спиралью – используют тогда, когда отсутствует опасность попадания на него нагреваемого вещества.
Сушильные шкафы предназначены для высушивания посуды и реактивов при температуре не более 150 °С.
Муфельные печи используют для прокаливания твердых веществ сплавления и других работ, требующих применения высоких температурах (500 °С и более).
Водяные бани используют для нагреванием до 100 °С. Они представляют собой металлический сосуд, который закрывается сверху концентрическими, налегающими одно на другое кольцами. Для получения более высоких температур в баню заливают жидкости с большей температурой кипения (глицерин, парафин).
Песчаная баня может быть использована для нагревания до 200 - 300 °С. Нагревание песка производят пламенем газовой горелки или электроплиткой.
Термостаты предназначены для автоматического поддержания постоянной температуры при проведении опытов.
Взвешивание
При взвешивании могут использоваться технохимические, аналитические и микровесы. Основное отличие этих весов состоит в точности взвешивания. Для выполнения лабораторных работ студенты используют технохимические весы, которые позволяют взвешивать с точностью до 0,01 г.
 Устройство технохимических весов. Основной частью весов (рис. 10) является коромысло. Посредине коромысла укреплена трехгранная призма из высококачественной стали, обращенная острием вниз. Этой призмой коромысло опирается на подушку, сделанную из того же материала. На концах коромысла находятся призмы, обращенные остриями вверх. На этих призмах лежат подушки, к которым на дужках подвешиваются чашки весов. В средней части коромысла укреплена стрелка, а на опорной колонке внизу имеется шкала с делениями.
Устройство технохимических весов. Основной частью весов (рис. 10) является коромысло. Посредине коромысла укреплена трехгранная призма из высококачественной стали, обращенная острием вниз. Этой призмой коромысло опирается на подушку, сделанную из того же материала. На концах коромысла находятся призмы, обращенные остриями вверх. На этих призмах лежат подушки, к которым на дужках подвешиваются чашки весов. В средней части коромысла укреплена стрелка, а на опорной колонке внизу имеется шкала с делениями.
При взвешивании на технохимических весах:
1. Проверьте правильность установки весов и определите их нулевую точку. Для определения нулевой точки поднимите коромысло весов при помощи арретира и наблюдайте за стрелкой. При открытом арретире стрелка исправных весов будет все время колебаться. Совершенно недопустимо успокаивать ее рукой и подводить к нулевому делению. Если стрелка отклоняется не на одинаковое число делений от нулевой точки, весы не отрегулированы и нужно сообщить об этом преподавателю.
2. Взвешиваемый предмет всегда помешают на левую чашку весов, а гирьки на правую. Никакие вещества, даже самые инертные, нельзя помещать непосредственно на чашку весов. Сначала взвешивают тару, в качестве которой используют часовое или предметное стекло, бюкс, бумажный фильтр, стакан и т.д., а затем тару с веществом.
Нельзя ставить на весы нагретый предмет. От него поднимаются потоки теплого воздуха, что изменяет положение равновесия коромысла, и масса определяется неверно.
3. Для взвешивания используют стандартный набор гирь. Набор составлен таким образом, чтобы минимальным числом гирь можно было бы взвесить любую массу от 0,01 до 200 г с точностью да 0,01 г. Во избежание загрязнения гирь и изменения массы их следует брать только пинцетом.
 4. При взвешивании на правую чашку весов кладут гирьку большей массы, чем предполагаемая масса взвешиваемого объекта. При накладывании и снятии гирь весы должны быть арретированы. Слегка приоткрывая арретир, определяют, действительно ли масса гири превышает массу предмета. Если это так, то, закрыв арретир, снимают гирьку, а на весы ставят следующую гирю меньшей массы. Вновь приоткрывают арретир: если мало – добавляют следующую за ней гирьку. Когда масса гирь начинает приближаться к массе объекта, арретир открывают полностью и наблюдают за стрелкой. Когда равновесие стрелки достигнуто, нужно закрыть арретир и сразу записать массу объекта в журнал. Взвешивание на технохимических весах считают законченным, если разновес в 0,01 г оказывается недостаточным, а 0,02 г – избыточным.
4. При взвешивании на правую чашку весов кладут гирьку большей массы, чем предполагаемая масса взвешиваемого объекта. При накладывании и снятии гирь весы должны быть арретированы. Слегка приоткрывая арретир, определяют, действительно ли масса гири превышает массу предмета. Если это так, то, закрыв арретир, снимают гирьку, а на весы ставят следующую гирю меньшей массы. Вновь приоткрывают арретир: если мало – добавляют следующую за ней гирьку. Когда масса гирь начинает приближаться к массе объекта, арретир открывают полностью и наблюдают за стрелкой. Когда равновесие стрелки достигнуто, нужно закрыть арретир и сразу записать массу объекта в журнал. Взвешивание на технохимических весах считают законченным, если разновес в 0,01 г оказывается недостаточным, а 0,02 г – избыточным.
На аналитических демпферных весах (рис. 11) десятые и сотые доли грамма нагружают при помощи особого механизма, управление которым осуществляют специальными дисками, расположенными справа на передней панели весов. Тысячные и десятитысячные доли грамма отсчитывают по положению стрелки на освещенной шкале, находящейся в нижней части весов между его чашками. Результат взвешивания на аналитических весах приводится с точностью до 0,0002 г.
Фильтрование
Фильтрование применяют для разделения твердой и жидкой фаз системы. В качестве фильтрующего материала используют бумагу, ткань, стекло различной пористости. Наименее плотные фильтры – быстро фильтрующие – предназначены для аморфных осадков. Фильтры средней плотности предназначены для кристаллических осадков, а наиболее плотные – для мелкокристаллических осадков. Для фильтрования наиболее часто используют простые и складчатые бумажные фильтры. У складчатого фильтра больше фильтрующая поверхность. Размер фильтра должен быть таков, чтобы верхний край его не доходил до края стеклянной воронки на 3 ‑ 5 мм.
 При фильтровании (рис. 12) воронку с фильтром укрепляют в кольце штатива, фарфоровом треугольнике, иногда вставляют непосредственно в горло колбы.
При фильтровании (рис. 12) воронку с фильтром укрепляют в кольце штатива, фарфоровом треугольнике, иногда вставляют непосредственно в горло колбы.
Воронку устанавливают так, чтобы скошенный конец ее касался стенки сосуда, в который собирают фильтрат. Вливать смесь жидкости с твердым веществом следует по стеклянной палочке. Воронку нужно заполнять жидкостью так, чтобы уровень ее был на 2 - 3 мм ниже края фильтра.
Нагревание
Нагревание растворов или твердых веществ можно проводить в пробирке, стакане, круглодонной колбе. В качестве нагревателя используют спиртовки, газовые горелки, электроплитки, водяные и песчаные бани.
Нагревание в пробирке. В пробирку наливают 2 - 3 мл раствора. Пробирку закрепляют в пробиркодержателе. Отверстие пробирки направляют в сторону от себя и окружающих. Нагревают на спиртовке равномерно, перемещая заполненную часть пробирки вдоль пламени, не перегревая одном месте.
Нагревание в стакане. Стакан должен быть наполнен раствором к ⅓ - ⅔ объема. Раствор перемешивают стеклянной палочкой. Перемешивание особенно важно, если нагревается раствор с осадком.
Нагревание в круглодонной колбе. Колбу укрепляют в штативе, зажав лапкой горло колбы или поставив на кольцо с железной сеткой. Наливают раствор (не более 2/3 объема колбы) и для равномерного кипения помещают в колбу кусочки пористой керамики или стеклянные капилляры.
Сушка
Сушка посуды. Химическая посуда никогда не вытирается изнутри, высушивание производится в сушильном шкафу. Мерную посуду, имеющую утолщенное дно, во избежание растрескивания никогда не сушат нагреванием. Ее сушат на специальных подставках.
Высушивание осадков. Сырой продукт отжимают между листами фильтровальной бумаги. Вначале сушат на воздухе. Этот способ может быть применен к веществам негигроскопичным. Дня ускорения процесс сушки проводят при повышенной температуре в сушильных шкафах. Этот метод рекомендуется только для устойчивых соединений с высокой температурой плавления. Вещество, помещенное в чашку Петри или бюкс, ставят на полку сушильного шкафа и включают обогрев, настроенный на нужную температуру. Гигроскопичные вещества сушат в эксикаторе. Осушаемое вещество в открытом сосуде ставят на вкладыш эксикатора. На дно эксикатора помещают поглотитель воды – безводный хлорид кальция, оксид фосфора (V).
Измерение температуры
Термометры используют для измерения температур в интервале 0 ‑ 500 °С. Они представляют собой стеклянные трубки с капилляром внутри и с резервуаром, заполненным различными жидкостями в зависимости от соответствующего интервала измеряемых температур. Наибольшее применение нашли ртутные и спиртовые термометры.
При измерении температуры какой-либо жидкости термометр погружают в нее таким образом, чтобы он находился на одинаковом расстоянии от стенок сосуда, и ни в коем случае не касался их. Резервуар термометра полностью погружают в жидкость. Термометр в жидкости держат до тех пор, пока не перестанет подниматься или опускаться столбик ртути или спирта.
Термисторы – это полупроводниковые приборы, которые способны изменять свою электропроводность при изменении температуры. При повышении температуры сопротивление термистора уменьшается. По калибровочной кривой к данному термистору определяют температуру среды.
Наполнение сосудов газом
Наполнение сосудов газом производят методом вытеснения воздуха (рис. 13). Пробирку-приемник закрепляют в штативе отверстием вверх для газов тяжелее воздуха (рис. 13а) и отверстием вниз (рис. 13б) – для газов легче воздуха. Газы с плотностью близкой к плотности воздуха и практически нерастворимые в воде собирают методом вытеснения воды (рис. 13в).

Рис. 13. Наполнение сосудов газом: а) газ тяжелее воздуха;
б) газ легче воздуха; в) плотности газа и воздуха близки.
Мытье посуды
Все опыты в химической лаборатории нужно проводить только в чистой посуде. Даже ничтожные количества загрязнений могут повлиять на ход химических процессов. Обычно стеклянная посуда считается чистой, если при внимательном осмотре не обнаружено никаких загрязнений, а вода после ополаскивания образует на стенках сплошную тонкую пленку.
Если на стенках посуды имеется налет каких-либо веществ, которые не отмываются водой, посуду вначале очищают ершом. Во избежание повреждений посуды при работе с ершом нужно следить, чтобы нижний конец его не ударялся о дно и стенки посуды. Хорошо вымытую посуду обязательно ополаскивают 2 - 3 раза дистиллированной водой для удаления солей, содержащихся в водопроводной воде.
Для мытья посуды моющими средствами можно использовать мыло, 10%-ный раствор тринатрийфосфата или соды. При мытье колб в них помещают кусочки чистой фильтровальной или другой мягкой бумаги. При встряхивании колбы бумага механически удаляет со стенок приставшие к ним загрязнения. Удаление загрязнений может быть достигнуто и химическим путем – промыванием посуды хромовой смесью (смесь концентрированной серной кислоты и хромового ангидрида). После промывания посуды хромовую смесь выливают обратно в предназначенную для нее склянку. Посуду тщательно моют водопроводной и ополаскивают дистиллированной водой. Иногда для мытья посуды используют спиртовой раствор щелочи. Мыть посуду необходимо сразу после ее использования.
ТРЕБОВАНИЯ К ОФОРМЛЕНИЮ ОТЧЕТА ПО ЛАБОРАТОРНОЙ РАБОТЕ
Результаты выполненной лабораторной работы следует оформлять в виде отчета. Содержание отчета должно представлять собой связанный и логически последовательный текст, содержащий ответы на все вопросы, поставленные в работе.
В отчете должно быть:
1. Название лабораторной работы и каждого опыта.
2. Дата выполнения лабораторной работы.
3. Указана цель лабораторной работы.
4. Описание последовательности и условий проведения опытов.
5. Рисунок или схема используемого прибора.
6. Уравнения всех происходящих в опытах реакций.
7. Описание признаков происходящих всех реакций: изменение окраски, выпадение осадка (цвет и внешний вид), выделение газов (цвет и запах) и т.д.
8. Расчеты, связанные с выполнением опытов. Таблицы. Графики.
9. Выводы по каждому опыту и работе в целом, отражающие сущность процессов или свойства веществ.
10.Титульный лист для лабораторного журнала рекомендуется оформлять по образцу.
(Образец)
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
САМАРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ
ЛАБОРАТОРНЫЙ ЖУРНАЛ
Выполнил: студент 1 курса,
Группа
Ф.И.О. студента
Проверил: Ф.И.О. преподавателя
Самара 20…/20… уч. г.
Лабораторная работа № 1
ПОЛУЧЕНИЕ КИСЛОТ
ОПЫТ 2.1. Взаимодействие кислотного оксида с водой
(Демонстрационно).
 Рис. 14. Получение кислот Рис. 14. Получение кислот |
Налейте в колбу немного дистиллированной воды и прибавьте 2-3 капли лакмуса. По его окраске определите характер среды. В железной ложечке нагрейте порошок серы до воспламенения и осторожно опустите ложку в колбу с водой. После сгорания серы содержимое колбы перемешайте. Что наблюдается? Напишите уравнения реакции горения серы и растворения оксида серы (IV) в воде (рис. 14).
ОПЫТ 2.2. Взаимодействие соли с кислотой.
Поместите в пробирку немного кристаллического ацетата натрия и облейте его разбавленным раствором серной кислоты. Отметьте образование уксусной кислоты по запаху. Напишите уравнение реакции.
Лабораторная работа № 2
Лабораторная работа № 3
Лабораторная работа № 4
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Цель работы: изучение явления комплексообразования, свойств и способов получения некоторых комплексов; исследование диссоциации комплексных и двойных солей и химических реакций с их участием.
Теоретическая часть
Сложные химические соединения, получившие название комплексных, состоят из внутренней (координационной) и внешней сферы. Внутренняя сфера называется комплексным ионом. Например, в комплексном соединении [Ni(NH3)6]SO4 комплексным ионом или внутренней сферой является ион [Ni(NH3)6]2+, а внешней сферой - ион SO42-.
Комплексное соединение в растворе диссоциирует на комплексный ион и ион внешней сферы. Диссоциация протекает по типу сильных электролитов и называется первичной диссоциацией (I ступень):

В растворах диссоциация протекает преимущественно по первой ступени.
Комплексный ион диссоциирует по типу слабых электролитов, т.е. в незначительной мере – вторичная диссоциация (II ступень):

Константа, отвечающая этому равновесию, называется константой нестойкости (Кн) комплексного иона:

Константа нестойкости характеризует каждый комплексный ион и является мерой устойчивости комплекса. Чем устойчивее комплексный ион, тем меньше его константа нестойкости.
Комплексы бывают катионные – комплексный ион заряжен положительно [Cu(H2O)4]Cl2, анионные K4[Fe(CN)6] – комплексный ион отрицательный. Нейтральные комплексы состоят только из внутренней сферы - [Сг(СО)6], поэтому они обычно не диссоциируют и их растворы не проводят электрический ток и их часто называют неорганическими неэлектролитами.
ОПЫТ 1. Образование соединений с комплексным катионом.
Поместить в две пробирки по 3 - 4 капли раствора сульфата меди и добавить в одну из них две капли хлорида бария, а в другую - раствора щелочи. На присутствие каких ионов в растворе указывают образовавшиеся осадки? Написать уравнения реакций.
Поместить в пробирку 4 - 5 капель раствора сульфата меди и по каплям добавить раствор аммиака до образования осадка гидроксосульфата меди. К раствору с осадком добавить раствор аммиака до растворения осадка в результате образования комплексной соли - аммиаката меди. Написать уравнения реакций получения гидроксосульфата и аммиаката меди (координационное число меди равно 4).
Полученный раствор аммиаката меди разделить на две части и провести те же два опыта, которые были проделаны с раствором сульфата меди. Образуется ли осадок гидроксида меди? На основании проделанных опытов написать уравнение диссоциации аммиаката меди.
ОПЫТ 2. Образование соединения с комплексным анионом.
К двум каплям раствора нитрата серебра добавить раствор хлорида калия до образования осадка. К осадку по каплям прилить раствор тиосульфата натрия Na2S2O3 до его растворения вследствие образования тиосульфатного комплекса серебра (координационное число серебра равно двум). Написать уравнения протекающих реакций.
К раствору тиосульфатного комплекса серебра прибавить 1 - 2 капли хлорида калия. Образуется ли осадок хлорида серебра? Написать уравнение диссоциации тиосульфатного комплекса серебра.
ОПЫТ 3. Прочность комплексных ионов и разрушение комплексов.
К 2 - 3 каплям концентрированного раствора хлорида кобальта (II) добавить концентрированный раствор роданида аммония NH4CNS до изменения окраски в результате образования роданидного комплекса кобальта. Написать уравнения реакции (координационное число кобальта равно 4).
Убедиться в устойчивости полученного соединения, добавляя по каплям дистиллированную воду до изменения окраски, обусловленной заменой лигандов CNS- на H2О. Написать уравнение реакции, учитывая, что координационное число кобальта в аквакомплексе равно шести. Написать уравнение диссоциации комплексных ионов [Co(CNS)4]2- и [Со(Н2О)6]2+ и выражения констант нестойкости. Объяснить, почему происходит замена лигандов.
ОПЫТ 4. Реакции обмена с участием комплексных соединений.
К 2 - 3 каплям раствора сульфата меди добавить такой же объем раствора комплексной соли K4[Fe(CN)6]. Отметить цвет образовавшегося осадка. Написать уравнение реакции в молекулярной и ионной формах.
ОПЫТ 5. Диссоциация двойных солей.
Проделать качественные реакции на ионы Fe3+ и SO42-. Для этого к 2 -3 каплям раствора хлорида железа (III) добавить 1 - 2 капли раствора роданида аммония NH4CNS. Отметить цвет образовавшегося осадка роданида железа. Написать уравнение реакции.
К 2 - 3 каплям раствора сульфата натрия добавить 1-2 капли хлорида бария. Отметить цвет осадка. Написать уравнение реакции.
Внести в две пробирки по 1 - 2 капли раствора двойной соли NH4Fe(SO4)2. В одну пробирку добавить 1 - 2 капли раствора роданида аммония, а в другую – 1 - 2 капли раствора хлорида бария. Отметить происходящие в результате реакций изменения. Написать уравнения реакций.
На основании проделанных опытов записать уравнение электролитической диссоциации двойной соли. Сделайте вывод по работе на основании проделанных опытов.
Контрольные вопросы
1. Каков механизм образования донорно-акцепторной связи? Укажите донор в следующих комплексных ионах: [Ni(NH3)6]2+, [SiF6]2-, [HgI4]2-
2. Орбитали каких энергетических уровней в ионе Cr3+ принимают участие в образовании химической связи в комплексном ионе [Cr(NH3)6]3+.
3. Приведите пример катионного и анионного комплексных соединений для Cr3+. Координационное число Сг3+ равно 6.
4. Роданид калия KCNS при добавлении к раствору соли (NH4)2SO4×Fe(SO4)3 связывает ион Fe3+ в роданид железа, а при добавлении к раствору соли 3KCN×Fe(CN)3 – не связывает. Какая из этих солей двойная, а какая комплексная? Приведите уравнения диссоциации обеих солей в водных растворах.
Лабораторная работа № 5.
Лабораторная работа № 6
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Цель работы: изучение скорости химической реакции и ее зависимости от различных факторов - природы реагирующих веществ, концентрации, температуры, наличия катализатора, а также исследование влияния концентрации на положение химического равновесия.
ПРЕДВАРИТЕЛЬНЫЙ ОПЫТ
Налейте в пробирку 3-4 мл раствора тиосульфата натрия (Na2S2O3) и равный объем серной кислоты; перемешайте раствор и наблюдайте через некоторое время помутнение раствора в результате выпадения коллоидной серы.
Напишите уравнение реакции. По времени от момента сливания растворов до появления опалесценции можно судить о скорости данной реакции. Взяв эту реакцию в качестве модельной, исследуйте влияние концентрации и температуры на скорость.
ОПЫТ 1.1. Зависимость скорости реакции от концентрации реагирующих веществ.
Составьте таблицу эксперимента (табл. 3).
Заданные в таблице объемы раствора тиосульфата натрия и воды отмерьте бюретками попарно в три пронумерованные пробирки 1, 2, 3. В пробирки 1а, 2а и За из бюретки налейте по 2 мл серной кислоты.
Влейте серную кислоту из пробирки 1а в смесь тиосульфата и воды - в стакан №1 и определите по секундомеру время от момента слипания до по явления первых признаков образования серы (опыт 1). Полученный результат запишите.
Таблица 3
Лабораторная работа № 7
Выполнение работы
1. Найти по таблице процентную концентрацию кислоты. Она равна 12 %.
2. Рассчитать объем исходной кислоты, необходимый для приготовления заданного объема раствора. Определяется количество граммов кислоты в 250 мл ее раствора при концентрации Ск = 0,08.
m1 = Vk × Ск × Mэ(HCl) = 0,25 × 0,08 × 36,5 = 0,73 г
где Mэ(HCl) – молярная масса эквивалента соляной кислоты.
Масса кислоты исходной процентной концентрации:
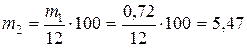 г
г
По плотности определяем объем исходной кислоты:
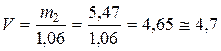 мл
мл
 3. Приготовить 250 мл раствора соляной кислоты заданной концентрации. Для этого налить в мерный цилиндр из склянки 4,7 мл исходной кислоты (рис. 18). Необходимый уровень доводится капельницей. Кислота из цилиндра количественно переносится в мерную колбу, после чего цилиндр два раза ополаскивается дистиллированной водой, которая также выливается в мерную колбу. Последняя заполняется примерно до половины водой; раствор тщательно перемешивается. Затем в колбу до метки по нижнему уровню мениска доливается вода. После перемешивания раствор считается приготовленным.
3. Приготовить 250 мл раствора соляной кислоты заданной концентрации. Для этого налить в мерный цилиндр из склянки 4,7 мл исходной кислоты (рис. 18). Необходимый уровень доводится капельницей. Кислота из цилиндра количественно переносится в мерную колбу, после чего цилиндр два раза ополаскивается дистиллированной водой, которая также выливается в мерную колбу. Последняя заполняется примерно до половины водой; раствор тщательно перемешивается. Затем в колбу до метки по нижнему уровню мениска доливается вода. После перемешивания раствор считается приготовленным.
ОПЫТ 2. Проверка нормальности приготовленного раствора титрованием.
Титрование - процесс постепенного прибавления раствора реактива к анализируемому раствору. Окончание титрования (точку эквивалентности) устанавливают либо при помощи индикатора 1, либо по изменению определенной физико-химической характеристики, например, потенциала электрода, опущенного в анализируемый раствор 2.
Выполнение работы
 В две конические колбы отмерить пипеткой по 10 мл приготовленного раствора кислоты. В каждую колбу добавить по 2-3 капли индикатора - фенолфталеина. При помощи воронки заполнить бюретку раствором щелочи с Сщ = 0,1. При этом необходимо слегка приподнимать воронку во избежание разлива щелочи. Убедиться в том, что стеклянный носик бюретки заполнен щелочью (рис. 19).
В две конические колбы отмерить пипеткой по 10 мл приготовленного раствора кислоты. В каждую колбу добавить по 2-3 капли индикатора - фенолфталеина. При помощи воронки заполнить бюретку раствором щелочи с Сщ = 0,1. При этом необходимо слегка приподнимать воронку во избежание разлива щелочи. Убедиться в том, что стеклянный носик бюретки заполнен щелочью (рис. 19).
Выпускание жидкости из бюретки производится через щель между резиновой трубкой и стеклянным шариком в ней при нажатии и сдвигании трубки пальцами. Установите уровень жидкости в бюретке на нуле по нижнему мениску, предварительно сняв воронку. Поставив колбу под бюретку (под колбу подложить лист белой бумаги), одной рукой осторожно, по каплям приливать раствор, непрерывно перемешивая его кругообразным вращением колбы другой рукой. Титрование ведется до появления слаборозового окрашивания, устойчивого не менее 10 - 15 с. Объемы щелочи на титрование не должны различаться между собой более чем на 0,1 - 0,2 мл. Для расчета берется среднее арифметическое объема щелочи четырех титрований.
Допустим, что в нашем примере среднее арифметическое значение объема щелочи, пошедшее на титрование, составило:
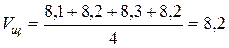 мл
мл
тогда нормальность кислоты оказывается равной:
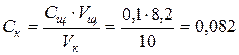
Ошибка в приготовлении раствора кислоты составляет
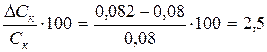 %
%
где DСK – разница между экспериментальным и расчетным значениями нормальности кислоты.
Контрольные вопросы
1. Назовите способы выражения концентрации растворов.
2. С какой целью при титровании раствора применяется индикаторы?
3. Что такое титр и титрованный раствор?
Лабораторная работа № 8
ОПРЕДЕЛЕНИЕ рН РАСТВОРОВ
Водородный показатель – это величина, характеризующая концентрацию водородных ионов и численно равная отрицательном десятичному логарифму этой концентрации, моль/л:
рН = – lg [H+].
При рН = 7 – среда нейтральная; при рН < 7 среда кислая; при рН > 7 – среда щелочная.
Для определения рН применяют калориметрические и электрометрические методы.
При калориметрическом методе определения рН пользуются индикаторной бумагой и жидкими индикаторами.
ОПЫТ 1.1. Определение рН растворов посредством универсальной индикаторной бумаги.
Пользуясь индикаторной бумагой, определить рН растворов воды, уксусной, соляной кислот, гидроксида аммония, гидроксида натрия, сульфата алюминия, карбоната натрия, гидрокарбоната натрия, хлорида натрия, ацетата натрия и ацетата аммония.
Таблица 6
| № п/п | Форму Наши рекомендации
|
