Опыт 2. Определение теплоты реакции нейтрализации
Реакцией нейтрализации называют реакцию взаимодействия кислоты и основания. Определим тепловой эффект реакции:
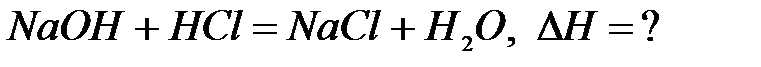
Установлено, что теплота реакции нейтрализации любой сильной кислоты любым сильным основанием (ΔНнейтр.) является величиной постоянной и равной 13,7 ккал/моль. Этот факт объяснила теория электролитической диссоциации Аррениуса, согласно которой любая реакция нейтрализации сводится к процессу: 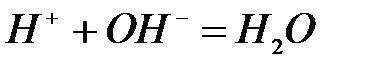 . То есть тепловой эффект реакции нейтрализации является тепловым эффектом реакции образования 1 моль воды. Именно поэтому он одинаков для реакции нейтрализации любыми сильными основаниями любых сильных кислот.
. То есть тепловой эффект реакции нейтрализации является тепловым эффектом реакции образования 1 моль воды. Именно поэтому он одинаков для реакции нейтрализации любыми сильными основаниями любых сильных кислот.
В случае нейтрализации слабых кислот и оснований тепловой эффект реакции зависит от природы взятых веществ. Это связано с тем, что процессу образования воды из ионов Н+ и ОН- предшествует распад вещества на ионы, т. е. тепловой эффект этого процесса входит в теплоту нейтрализации.
1. В сухой внутренний стакан калориметра налейте 25 мл 1 М раствора гидроксида натрия, точно отмеренного пипеткой или бюреткой.
2. Опустите в раствор щелочи, не касаясь дна и стенок стакана, термометр и замерьте температуру с точностью до 0,1 °С (tнач).
3. В небольшой стаканчик налейте 25 мл 1 М раствора соляной кислоты и измерьте ее температуру.
4. Быстро и очень осторожно вылейте раствор кислоты во внутренний сосуд калориметра и, помешивая мешалкой, наблюдайте за изменением температуры.
Запись данных опыта.Запишите показания термометра с точностью до 0,1оС в течение 5 минут с интервалом в 1 мин. Результаты измерений занесите в таблицу 5.2.
Таблица 5.2. Определение теплоты реакции нейтрализации
| Время от начала опыта, мин | ||||||
| Температура, оС |
| Время от начала опыта, мин | ||||||
| Температура, оС |
По полученным экспериментальным данным постройте график зависимости t = f(τ). Определите по графику tmax – максимальную температуру раствора.
3) По формуле (5.5) определите количество теплоты ΔН, выделившееся при нейтрализации 25 мл 1 М раствора соляной кислоты 25 мл 1 М раствором щелочи NaOH. Формула (5.5) примет вид:
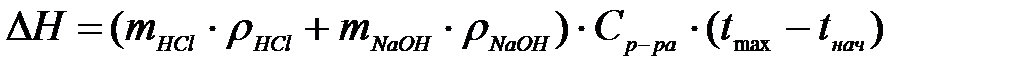 ,
,
где ρ – плотность, г/см3; С – удельная теплоемкость.
Так как растворы разбавленные, то принимаем плотность всех растворов равными плотности воды (1 г/см3). Теплоемкость воды определяем по справочнику (4,184 Дж/моль).
Тогда,
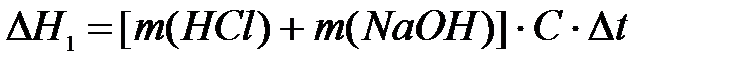 , кДж/моль·К, (5.9)
, кДж/моль·К, (5.9)
где массы кислоты и щелочи равны их объемам (в мл), поскольку плотность раствора мы приняли равной 1 г/см3 (1 мл = 1 см3).
По уравнению реакции нейтрализации рассчитайте тепловой эффект нейтрализации 1 моль кислоты (в кДж) (используя формулу 4.10), учитывая, что 25 мл 1М раствора содержат 0,025 моль кислоты.
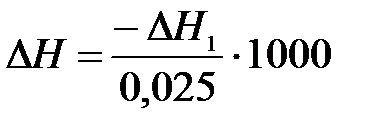 , кДж/моль. (5.10)
, кДж/моль. (5.10)
Определите относительную ошибку опыта (δ) по формуле (5.8), если теоретическое значение теплового эффекта реакции нейтрализации 1 моль сильной кислоты сильной щелочью равно 57,3 кДж.
Относительная ошибка измерения не должна превышать 10%.
Расчеты:
Содержание отчета и его форма
Каждый студент должен иметь лабораторный журнал, который является документом, отражающим всю его работу. Все наблюдения и выводы по экспериментальной работе, проделанной в лаборатории, студент заносит в лабораторный журнал непосредственно после ее выполнения.
Отчет по лабораторной работе должен состоять из даты, названия и номера лабораторной работы, цели работы, методики проведения опытов, наблюдений, уравнений химических реакций, выводов и расчетов (формулы, таблицы, графики).
Дата___________
ЛАБОРАТОРНАЯ РАБОТА 6
