Все осадки растворимы в минеральных кислотах, аммиаке и солях аммония
(CuOH)2SO4 + 6 NH4OH + (NH4)2SO4 → 2 [Cu(NH3)4]SO4 + 8 H2O
(CuOH)2SO4 + 6 NH4OH + 2 NH4+ → 2 [Cu(NH3)4]2+ + SO42‾ + 8 H2O
CuSO4 + 2 KOH → Cu(OH)2↓ + K2SO4
Cu2+ + 2 OH‾ → Cu(OH)2↓
Эти осадки растворяются в минеральных кислотах и концентрированном растворе аммиака (кроме HgO, который в NH4OH нерастворим).
CuSO4 + 2 NH4CNS → Cu(CNS)2↓ + (NH4)2SO4
Cu2+ + 2 CNS‾→ Cu(CNS)2↓
2 Cu(CNS)2 → 2 CuCNS↓ + (CNS)2 (родан)
Реакция протекает в кислой среде при нагревании.
2 CuSO4 + 2 Na2S2O3 + 2 H2O → Cu2S↓ + S↓ + 2 H2SO4 + 2 Na2SO4
2 Cu2+ + 2 S2O32‾ + 2 H2O → Cu2S↓ + S↓ + 4 H+ + 2 SO42‾
Реакции катионов ртути (Hg2+)
HgCl2 + 2 NH4OH → [NH2Hg]Cl↓ + NH4Cl + 2 H2O
Hg2+ + Cl‾ + 2 NH4OH → [NH2Hg]Cl↓ + NH4+ + 2 H2O
[NH2Hg]Cl + 2 NH4OH (конц.) + NH4Cl → [Hg(NH3)4]Cl2 + 2 Н2О
[NH2Hg]Cl + 2 NH4OH + NH4+ → [Hg(NH3)4]2+ + Cl‾ + 2 Н2О
HgCl2 + 2 KOH → HgO↓ + 2 KCl + H2O
Hg2+ + 2 OH‾ → HgO↓ + H2O
Hg(NO3)2 + 2 KI → HgI2↓ + 2 KNO3
Hg2+ + 2 I‾ → HgI2↓
Работа с осадком: р-м в изб. HgI2 + 2 KI → K2[HgI4] HgI2 + 2 I‾ → [HgI4]2‾
Щелочной раствор K2[HgI4] применяется для открытия ионов аммония под названием реактива Несслера.
Реакция на катион кадмия (Cd2+)
CdCl2 + 2 NH4OH → Cd(OH)2↓+ 2 NH4Cl Cd(OH)2 + 2 NH4OH + 2 NH4Cl → [Cd(NH3)4]Cl2 + 4 H2O
Cd2+ + 2 NH4OH → Cd(OH)2↓+ 2 NH4+ Cd(OH)2 + 2 NH4OH + 2 NH4+ → [Cd(NH3)4]2+ + 4 H2O
CdCl2 + 2 KOH → Cd(OH)2↓+ 2 KCl
Cd2+ + 2 OH‾ → Cd(OH)2↓
Cd(NO3)2 + 4 NH4OH + 2 KI → [Cd(NH3)4]I2↓+ 2 KNO3 + 4 H2O
Cd2+ + 4 NH4OH + 2 I‾ → [Cd(NH3)4]I2↓ + 4 H2O
Реакция на катион кобальта (Со2+)
CoCl2 + NH4OH → CoOHCl↓ + NH4Cl
Co2+ + Cl‾ + NH4OH → CoOHCl↓ + NH4+
CoOHCl + 5 NH4OH(изб.конц.) + NH4Cl → [Co(NH3)6]Cl2 + 6 H2O
CoOHCl + 5 NH4OH + NH4+ → [Co(NH3)6]2+ + Cl‾ + 6 H2O
CoCl2 + KOH → CoOHCl↓ + KCl
Co2+ + OH‾ + Cl‾ → CoOHCl
Раб. с осадком:CoOHCl + KOH → Co(OH)2↓ + KCl
CoOHCl + OH‾ → Co(OH)2↓ + Cl‾
CoCl2 + 4 NH4CNS → (NH4)2[Co(CNS)4] + 2 NH4Cl
Co2+ + 4 CNS‾ → [Co(CNS)4]2‾
При добавлении амилового спирта на поверхность раствора всплывает интенсивно-синий спиртовой слой, окраска которого обусловлена наличием недиссоциированных молекул (NH4)2[Co(CNS)4]:
а) пробирочный метод: к 3-4 каплям раствора соли Со2+ приливают избыток насыщенного раствора NH4CNS и 5 капель амилового спирта. Наблюдают темно-синий спиртовой слой.
Реакция катионов никеля (Ni2+)
NiCl2 + NH4OH → NiOHCl↓ + NH4Cl NiOHCl + 5 NH4OH + NH4Cl → [Ni(NH3)6]Cl2 + 6 H2O
Ni2+ + Cl‾ + NH4OH → NiOHCl↓ + NH4+ NiOHCl + 5 NH4OH + NH4+ → [Ni(NH3)6]2+ + 6 H2O
NiCl2 + 2 KOH → Ni(OH)2↓ + 2 KCl
Ni2+ + 2 OH‾ → Ni(OH)2↓
Специфическим реактивом на катион Ni2+ является диметилглиоксим (реактив Л.А. Чугаева).
В результате этой реакции образуется внутрикомплексная соль никеля диметилглиоксимат, обладающая характерной ало-красной окраской:
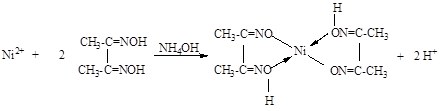
35. Систематический анализ смеси катионов VI аналитической группы.
| Анализируемый раствор: Cu2+, Hg2+, Cd2+, Co2+, Ni2+ | Осадок 1: основная соль Со2+ и соль меркураммония | |
 Приливают разбавленный рас-твор NH4OH и центрифугируют Приливают разбавленный рас-твор NH4OH и центрифугируют |  | Обрабатывают разбавленной H2SO4 и центрифугируют |

| Осадок 3: Cu2S |
| Растворяют в разб. HNO3 и открывают Cu2+ аммония роданидом |
| Раствор 4: Cd2+, Ni2+ | |
| Порцию раствора 4 кипятят, обрабатывают NH4OH и открывают Ni2+ диметилглиоксимом | Открывают Cd2+ из отдельной пробы раствора 4 при помощи КI в присутствии избытка NH4OH |
| Раствор 2: аммиакаты меди, кадмия и никеля |
| Обрабатывают Na2S2O3 (кр.) в присутствии H2SO4 и центрифу-гируют |
| Раствор 3: Со2+ | Осадок 2: соль меркураммония |
| Открывают аммония роданидом | Растворяют в конц. HNO3 и открывают Hg2+ |
36. Систематический анализ смеси катионов IV-VI аналитической группы.
Систематический ход открытия катионов данных аналитических групп основан на различном отношении их к растворам щелочей и аммиака. Следует иметь в виду, что в составе катионов четвертой, пятой и шестой групп имеется ряд таких ионов, поведение которых обуславливает их сходство с катионами других аналитических групп.
Так, например, гидроксид цинка обладает ярко выраженными амфотерными свойствами, и Zn2+ легко переходит в раствор под действием аммиака, поскольку цинк является хорошим комплексообразователем аммиакатов. Следовательно, катионы цинка могут быть отнесены как к четвертой, так и шестой аналитической группе.
Катионы кобальта и ртути(II) могут быть отнесены и к пятой, и к шестой группам, т.к. при действии избытка NH4OH (без добавления к раствору NH4CI или NH4NO3) эти катионы в растворимые комплексные соли практически не переходят.
Таким образом, в зависимости от последовательности обработки раствора, состоящего из смеси катионов IV–VI аналитических групп щелочами и раствором аммиака, а также от концентрации последних и условий обработки ими этого раствора, можно получить различные результаты отдельных групп тех или иных катионов.
Так, например:
1) если на анализируемый раствор смеси катионов IV-VI групп действовать избытком разбавленного раствора NH4OH, то в осадок при этом перейдут все катионы IV-VI групп, за исключение катионов Cd2+, Cu2+, Ni2+ и, при наличии в растворе катионов Cr3+, часть катионов цинка. Если в растворе отсутствуют ионы Cr3+, то цинк полностью перейдет в растворимые аммиакаты.
2) если анализируемый раствор обработать 2-3-х кратными объемами концентрированного NH4OH, то в растворе, кроме того, окажутся и катионы Hg2+ и Co2+, т.е. катионы шестой группы и Zn2+.
3) если анализируемый раствор обработать при нагревании раствором карбоната калия или натрия в присутствии Н2О2, то все катионы при этом перейдут в осадок, за исключением хрома и мышьяка, которые окажутся в растворе в виде CrO42‾ и AsO43‾.
4) при обработке раствора едкой щелочью в присутствии Н2О2 в растворе останутся только катионы четвертой группы.
5) если обработку раствора производить едкой щелочью без Н2О2, то при совместном присутствии в растворе катионов Cr3+ и Zn2+, они в эквивалентном соотношении перейдут в осадок (процесс соосаждения).
6) если анализируемый раствор разбавить в 3-4 раза водой, то из него частично выпадут в осадок гидроксиды олова, сурьмы, висмута (гидролиз). Аналогичная обработка раствора в азотнокислой среде осаждает из него только гидроксид сурьмы.
Следовательно, в зависимости от той или иной обработки анализируемого раствора аммиаком, карбонатом натрия или калия, едкой щелочью и водой можно по-разному составить схему систематического хода анализа, т.е. схему последовательности их выделения и открытия.
Задание:
Провести систематический анализ раствора, содержащего смесь катионов IV-VI аналитических групп в соответствии со схемой 10.
Схема 10
