Свойства атомов и ионов
Способность атомов терять или присоединять электроны определяет химическую активность соответствующего элемента. Эту способность характеризуют при помощи следующих основных свойств атомов:
1. Энергия ионизации I – энергия, необходимая для удаления 1 моль электронов от 1 моль атомов какого либо элемента. Ее измеряют в кДж/моль или в электрон-вольтах (1 эВ = 1,6×10-19 Дж). Отрыву первого электрона от нейтрального атома соответствует первая энергия ионизации I1, отрыву второго, третьего и т. д. электронов соответствует вторая I2, третья I3 и т. д. энергии ионизации. При переходе от I1 к I2, I3 и т.д. энергия ионизации увеличивается. Наименьшее напряжение электрического поля, при котором происходит отрыв электрона, называется потенциалом ионизации. Его численное значение равно энергии ионизации в эВ.
Энергия ионизации характеризует восстановительную способность элемента. Чем меньше значение I, тем более сильным восстановителем является атом. В периодах с увеличением порядкового номера элемента (слева направо) I1 имеет общую тенденцию к росту. Однако, у электронных конфигураций, имеющих полностью или наполовину сформированные валентные подуровни, проявляются локальные максимумы значений I1.
Например, во втором периоде при переходе от N7: 1s22s22p3 к О8:1s22s22p4 порядковый номер увеличивается, а первая энергия ионизации уменьшается от 14,53 эВ у азота до 13,61 эВ у кислорода.
В общем случае локальные максимумы значений I1 следует ожидать у атомов, чья электронная формула заканчивается …ns2, …np3, …np6, …(n – 1)d5, …(n – 1)d10 и т.д.
Общие тенденции изменения значения I1 и некоторых других свойств атомов в периодах и группах приведены в табл.3.
Таблица 3
Зависимость некоторых свойств элементов и их соединений от Z
| Свойства | Изменение свойств элементов с ростом Z | |
| в периодах (слева направо) | в главных подгруппах (сверху вниз) | |
| Первая энергия ионизации I1* | увеличивается | уменьшается |
| Сродство к электрону F * | ||
| Относительная ЭО | ||
| Орбитальный радиус r | уменьшается | увеличивается |
| Окислительные | усиливаются | ослабевают |
| Неметаллические | ||
| Кислотный характер соединений | ||
| Восстановительные | ослабевают | усиливаются |
| Металлические | ||
| Основной характер соединений | ||
| Плотность простых веществ | увеличивается | возрастает по схеме I IV®VIII |
| Температуры кипения металлов | –––– | уменьшается |
| Способность к комплексообразованию (для d-элементов) | усиливается | усиливается в побочных подгруппах |
| Растворимость гидроксидов | от типичных металлов к амфотерным элементам убывает |
* - изменение свойства в периодах не монотонное, имеются локальные максимумы.
2. Сродство к электрону F (Дж/моль или эВ)– это энергия, которая выделяется при присоединении 1 моль электронов к 1 моль атомов. Данное свойство атома характеризует его окислительную способность: чем больше значение F, тем сильнее выражены окислительные свойства атома. В группах с увеличением порядкового номера элемента энергия сродства к электрону уменьшается, а в периодах – возрастает, но не монотонно. Локальные максимумы значений F смещены на один элемент влево по сравнению с энергией ионизации атома. Наибольшими значениями F обладают элементы VII (А) группы, а у большинства металлов и у благородных газов сродство к электрону невелико или отрицательно.
3. Электроотрицательность (ЭО) характеризует способность атомов притягивать к себе электроны. Эта величина имеет условный характер, так как способность атома притягивать электроны зависит от типа соединения и валентного состояния элемента.
По шкале Р. Малликена
ЭО = 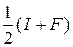 , эВ (8)
, эВ (8)
Использование шкалы Малликена затруднено, так как отсутствуют надежные методы определения сродства к электрону.
Более широкое использование получила относительная шкала электроотрицательностей Л. Полинга. По этой шкале абсолютная ЭО атома лития принята равной единице, а ЭО остальных атомов отнесены к значению абсолютной ЭО(Li). Максимальное значение относительной ЭО, которое равно 4, имеет атом фтора (ЭО(F) = 4). В периодах с ростом порядкового номера элемента электроотрицательность возрастает, а в группах, как правило, убывает.
Значения относительной ЭО некоторых элементов приведены в табл.4. Общая тенденция изменения относительной ЭО атомов в периодах и группах ПС приведена в табл.3.
Так как движение электрона имеет волновой характер, то невозможно оценить абсолютные размеры атомов. Поэтому на практике пользуются их условными размерами: орбитальным радиусом и эффективным радиусом.
Орбитальный радиус r – это теоретически рассчитанное расстояние от ядра до главного максимума электронной плотности внешней АО. Эффективные радиусы rэф атомов оценивают по экспериментальным данных, как ½ расстояния между центрами смежных атомов в кристалле. rэф затруднительно сравнивать между собой, так как на их значение оказывают влияние различные факторы (структура вещества, характер связи, СО элемента и т.д.). Периодичность изменения орбитальных радиусов атомов приведена в табл.3.
При образовании катиона r частицы уменьшается по сравнению с размером атома, причем, чем больше заряд катиона, тем меньше радиус. В случае образования аниона орбитальный радиус частицы возрастает тем больше, чем выше отрицательный заряд иона.
Закономерная периодическая повторяемость электронных структур валентных подуровней элементов, и как следствие, повторяемость их свойств, отражается в Периодическом законе, современная формулировка которого гласит: свойства химических элементов, а также формы и свойства образуемых ими соединений находятся в периодической зависимости от величины заряда ядер их атомов. Графическим отражением периодического закона является ПС элементов Д.И. Менделеева, в которой элементы расположены в порядке возрастания Z их атомов и подразделяются на естественные совокупности – периоды и группы.
Период – это горизонтальный ряд элементов, в атомах которых происходит заполнение одинакового числа электронных слоев. Номер периода совпадает со значением n внешнего энергетического уровня и показывает число электронных слоев атома. Зависимость свойств химических элементов и их соединений в периоде с увеличением Z атомов приведена в табл. 3.
Первые три периода содержат только s- и p-элементы и называются малыми. Четвертый и последующие периоды кроме s- и p-элементов содержат также d- и f-элементы и называются большими. У атомов s- и p-элементов свойства соседних атомов изменяются отчетливо, а для d- и в особенности для f-элементов одного и того же периода отличия в свойствах проявляется менее четко, так как у них происходит заполнение электронами внутренних энергетических уровней, тогда как конфигурация внешнего слоя практически не изменятся.
Таблица 4
