Алкалоиды и гликоалкалоиды
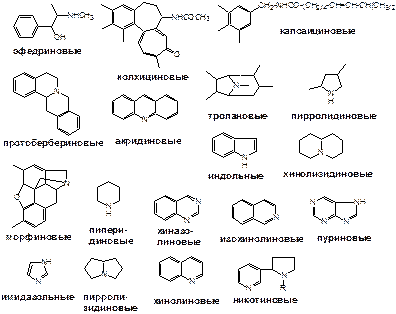
К алкалоидам принято относить азотсодержащие органические вещества основного характера, обладающие определенной физиологической активностью. Свое название эти вещества получили от латинского alkali (щелочь), хотя и не все алкалоиды имеют щелочной характер, например, четвертичные соли, слабоосновные или даже кислого характера азотистые гетероциклы. Структура алкалоидов очень разнообразна – от довольно простых алкилароматических аминов (эфедрин) до очень сложных конденсированных гетероциклических систем, в структуре которых содержится от 1 до 4-х атомов азота, многие из которых присущи только данному конкретному алкалоиду или небольшой их группе (резерпин, стрихнин, морфин, соласодин). По этой причине их химическая классификация весьма затруднена, к тому же большинство алкалоидов представлены в каком-либо ряду гетероциклов в единственном виде. Все они обладают основными свойствами, но их отличает большое разнообразие углеродных скелетов, например:
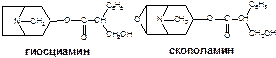 |
В листьях, траве и корнях красавки, листьях белены и дурмана семейства пасленовых (Solanaceae) доминируют близкие по структуре алкалоиды тропанового типа (гиосциамин + ОН- ® атропин, скополамин):
В траве термопсиса преобладают производные хинолизи-дина и основными являются термопсин, цитизин, пахикарпин:
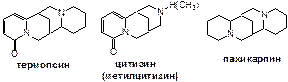 |
В траве различных видов крестовников преобладают производные пирролизидина (платифиллин и его N-оксид), в рожках спорыньи – индольные алкалоиды, в корнях барбариса – производные изохинолина и т.д.
Число выделенных из растений природных алкалоидов исчисляется тысячами и сотни из них нашли применение в медицине в качестве лекарственных препаратов. Среди алкалоидов широко известны сердечно-сосудистые средства (резерпин), спазмолитики (папаверин, платифиллин), стимуля-торы ЦНС (кофеин), снотворные и наркотические препараты (кокаин, морфин), противомалярийные средства (хинин), противоопухолевые препараты (колхамин, винбластин), т.е. алкалоиды представлены практически во всех фармакологи-ческих группах медицинских препаратов.
В структурах всех типов алкалоидов содержится первичный, вторичный или третичный атомы азота. Различают 11 основных и 5 смешанных групп алкалоидов:
§ алкалоиды без гетероциклов
§ пирролидиновые
§ пирролизидиновые
§ пиперидиновые
§ пиридиновые
§ пиперидиновые и пирролидиновые конденсированные
§ хинолиновые
§ хинолизидиновые
§ изохинолиновые
§ индольные
§ пуриновые
§ дитерпеновые
§ стероидные
§ гликоалкалоиды
§ флавоалкалоиды
§ смешанные
Являясь слабыми основаниями, алкалоиды образуют соли, разлагающиеся при действии щелочей, аммиака, карбонатов с выделением свободных оснований.
Алкалоиды–основания, легко растворимы в спирте, эфире, хлороформе, дихлорэтане. Алкалоиды-соли не растворимы в органических растворителях, кроме спирта.
Часто алкалоиды – оптически активны.
Сумма алкалоидов в одном растении может состоять из 20 и более структур с преобладанием 1-5 соединений в количествах от 0,01 до 15%.
Алкалоиды-основания в растениях связываются с различ-ными кислотами своего растения и в виде солей перемещаются по органам растения.
Подлинность алкалоидсодержащих растений определяют по макро- и микродиагностическим признакам, качественным реакциям и ВЭЖХ после извлечения из лекарственного растительного сырья.
Выделение:
1. Измельченное растительное сырье заливают 5% раствором кислоты уксусной в соотношении 1:10, перемешивают на магнитной мешалке в течение 1 часа, фильтруют.
2. 2-3 г препарата заливают 15 мл хлороформа, добавляют 1 мл концентрированного раствора аммиака при перемешивании в течение 1 часа. Хлороформ отфильтровывают (или отделяют в делительной воронке), отгоняют досуха. Сухой остаток растворяют при нагревании в 5 мл 0,1М раствора кислоты хлороводородной, фильтруют. Для проведения качественных реакций, как правило, используют от 1 до 5 мл извлечений.
Качественный анализ [12]:
q Добавляют 1-3 мл реактива Бушарда, Вагнера, Люголя (раствор 1.27 г йода в 100 мл раствора 2 г иодида калия в воде), появляется бурый осадок или окрашивание.
q Добавляют 2-3 мл реактива Майера (1.358 г ртути хлорида растворяют в 60 мл воды, добавляют раствор 5 г калия иодида в 10 мл воды и доводят объем раствора до 100 мл водой), подкисляют до нейтральной или слабо кислой среды, выпадают осадки белого или светло-желтого цвета (все алкалоиды, кроме кофеина и колхицина).
q Добавляют 1-5 мл реактива Драгендорфа (раствор 0.85 г висмута иодида или нитрата основного в 40 мл воды,10 мл кислоты уксусной (раствор 1). 2 г калия иодида растворяют в 50 мл воды очищенной (раствор 2). Смешивают равные объемы растворов 1 и 2, отбирают 10 мл полученной смеси, добавляют 100 мл воды очищенной и 20 мл кислоты уксусной ледяной, взбалтывают 15 минут) [10], выпадают осадки оранжевого, красного или кирпичного цвета (кислые растворы солей алкалоидов), оранжевое окрашивание (стероидные алкалоиды).
q Добавляют 1-3 мл реактива Зонненштейна (1% раствор кислоты фосфорномолибденовой) /Н7Р(Мо2О7)6·Н2О/, выпадают осадки белого, желтого или оранжевого цвета, которые при стоянии приобретают синие или зеленые оттенки.
q Добавляют 1-3 мл реактива Шейблера (1% раствор кислоты фосфорновольфрамовой) /Р2О5·12WO3·42Н2О/, появля-ется осадок разноокрашенный, чаще белого цвета.
q Добавляют 1-3 мл раствора танина (10 г танина растворяют в 90 мл воды очищенной, добавляют 10 мл спирта этилового 96%, перемешивают), выпадают осадки белого или желтого цвета в нейтральной или слабо кислой среде; от добавления 1-3 мл 0.1% раствора танина появляется белый осадок, растворимый в избытке реактива (кофеин).
q Добавляют 1-2 мл 1% водного раствора кислоты пикриновой (2,4,6-тринитрофенол), появляется окрашивание или выпадают осадки желтого цвета (все алкалоиды, кроме кофеина, морфина, аконитина, теобромина), атропин осаждается из концентрированных растворов.
q Добавляют 10 капель кислоты хлороводородной разведенной и 10 капель пергидроля, выпаривают на водяной бане досуха. К остатку добавляют 1-2 капли раствора аммиака, появляется пурпурно-красное окрашивание (кофеин).
q Добавляют 1-3 мл реактива Бертрана (1% раствор кремневольфрамовой кислоты) /SiО2· 12WO3·2Н2О/, появляется белый осадок (разные типы алкалоидов).
q 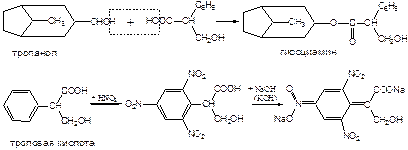
Реакция Витали-Морена. Добавляют 1-3 мл кислоты азотной концентрированной, выпаривают на водяной бане, появляется желтое окрашивание и осадок. При добавлении к осадку 1-3 мл 5% раствора натра едкого спиртового появляется фиолетовое окрашивание или осадок (производные троповой кислоты. Кокаин этой реакции не дает!).
q Добавляют 2-3 мл реактива Марме (раствор 10 г иодида кадмия в 100 мл 20% водного раствора калия иодида) /K2[CdI4]/, появляется белый или желтый осадок при стоянии постепенно растворимый в избытке реактива (все алкалоиды, кроме кофеина, атропина, колхицина, вератрина).
q Добавляют 1 мл бромной воды, появляется желтое окрашивание (сальсолидин), оранжевое (термопсин), ярко-красное (сальсолин). К 1 мл бромной воды прибавляют 1 мл раствора аммиака концентрированного, появляется зеленое окрашивание (хининовые, хинолиновые алкалоиды, пахикарпин).
q Добавляют 2-3 капли кислоты серной разведенной, появляется голубая флюоресценция (хинин).
q Добавляют 1-2 капли 1% раствора калия перманганата, выпадает фиолетовый осадок (кокаин).
q Добавляют 1-2 капли 3% раствора хлорида железа окисного нагревают 1-3 минуты, появляется зеленое, затем фиолетово-синее окрашивание. При добавлении 1 капли разбавленной кислоты азотной появляется красное окрашивание (морфиновые алкалоиды). При добавлении 1 капли кислоты азотной концентрированной появляется кроваво-красное окрашивание (апоморфин).
q Добавляют 1 мл кислоты азотной концентрированной, нагревают 1-2 минуты, добавляют 1 каплю 0.5 н раствора калия едкого и 1 мл ацетона, появляется фиолетовое окрашивание, исчезающее при стоянии (атропиновые, хининовые алкалоиды).
q Реакция Брэди. Добавляют 1-2 мл раствора 2.4-динитрофенилгидразина в кислоте хлороводородной, выпадает осадок желтого цвета (дигидрокодеинон в отличие от морфина, тебаина, кофеина).
q Реакция Фреде. Добавляют несколько капель 5% раствора аммония молибдата в кислоте серной концентри-рованной, появляется фиолетовое окрашивание, переходящее в синее, а при стоянии в зеленое (морфин).
q Реакция Альберта. Добавляют несколько капель 40% раствора формальдегида в сильно кислой среде (реактив Марки), появляется малиновое или малиново-красное окрашивание (морфин – пурпурное ® фиолетовое; кодеин – сине-фиолетовое; малиново-красное - гликоалкалоиды).
q Добавляют 1-3 мл насыщенного раствора сурьмы треххлористой в хлороформе нагревают, появляется кирпично-красное окрашивание (стероидные алкалоиды, стероидные амины).
q Добавляют несколько капель раствора меди сульфата и несколько капель раствора натра едкого, появляется синее окрашивание или осадок. Взбалтывают его с 1 мл эфира. Эфирный слой окрашивается в фиолетово-красный цвет, водный слой остается синим (эфедрин, алкалоиды со вторичной аминогруппой).
q Добавляют 2-3 мл 1% раствора кислоты винной и 1 мл раствора пара-диметиламинобензальдегида, появляется сине-фиолетовое окрашивание (алкалоиды спорыньи).
q Реакция Эрлиха: 1% пара-диметиламинобензальдегид в смеси (25% кислота соляная, этанол безводный 1:1), нагреть до 700С (УФ 254 и 336 нм) (эргокристин, дигидроэргокристин).
q Добавляют 1-3 мл 4% раствора кислоты винной в 50% растворе метанола, нагревают 3 минуты с перемешиванием, охлаждают, добавляют 2-3 мл реактива ван-Урка (К 35 мл воды приливают при перемешивании 65 мл кислоты серной концентрированной и 0.03 мл 10% раствора хлорида железа окисного. Охлаждают до 500С, добавляют 0.2 г пара-диметил-аминобензальдегида. Реактив используют после стояния в течение 24 часов), появляется сине-фиолетовое окрашивание (алкалоиды спорыньи).
q Добавляют 1 мл 5% раствора натрия ацетата, выпадает белый хлопьевидный осадок (наркотин, папаверин). Осадок на часовом стекле смешивают с несколькими кристаллами персульфата калия или аммония и 2 каплями кислоты серной концентрированной, появляется интенсивное красно-бурое окрашивание (наркотин). К фильтрату после отделения осадка добавляют несколько капель 5% раствора натра едкого и 3 мл эфира. Эфирное извлечение испаряют на часовом стекле досуха и к остатку добавляют 2 капли смеси из 1.5 мл формалина и 8.5 мл кислоты серной концентрированной, появляется фиолетовое окрашивание (кодеин).
q Добавляют 1-2 капли кислоты серной концентрирован-ной, появляется оранжевое окрашивание, быстро переходящее при стоянии в желтое (отличие кодеина от морфина).
q Добавляют 1-2 капли кислоты серной концентриро-ванной, 1 каплю 3% раствора хлорида железа окисного нагре-вают 1-2 минуты, появляется синее окрашивание, переходящее в красное при добавлении 1 капли кислоты азотной разведенной (кодеиновые алкалоиды).
q Добавляют 1-2 капли 1% раствора кислоты пикроловой, появляется ярко-желтое окрашивание, при стоянии выпадают осадки (алкалоиды, имеющие в структуре вторичный и третичный азот).
q Добавляют 1 мл 5% раствора натрия нитропруссида и 1 мл 5% натрия гидроксида, появляется вишневое окрашивание (пахикарпин). При добавлении 1 мл кислоты хлороводородной концентрированной сохраняется вишневое окрашивание (пилокарпин, сферофизин).
q Добавляют 1 мл 5% раствора кобальта нитрата, появля-ется голубоватое окрашивание, затем зеленый осадок (цитизин).
q Добавляют 1-2 капли 5% раствора кислоты стифниновой (1,3-диокси-2,4,6-тринитробензол), выпадает осадок желтого цвета (все алкалоиды).
q Добавляют 3 мл реактива Эрдмана (концентрирован-ные серная и азотная кислоты 1:1), появляется различное, чаще желтое окрашивание (алкалоиды-основания).
q Добавляют 1-3 кристалла гидроксиламина («гидрокса-мовая проба», появляется окрашивание, добавляют 1-2 мл 3% раствора железа окисного хлорида, окраска меняется до красно-фиолетовой (платифиллин, сложные эфиры).
Хроматографический анализ:
Помимо качественных реакций на различные группы алкалоидов, для обнаружения и идентификации, разделения и контроля степени очистки используют методы бумажной (БХ), тонкослойной (ТСХ), газожидкостной (ГЖХ) или высоко-эффективной жидкостной хроматографии (ВЭЖХ).
Для бумажной хроматографии используют системы: н-бутанол – уксусная кислота – вода (4:1:5), (10:2:3), (40:12.5:29); н-бутанол – соляная кислота – вода (100:4:до насыщения) с последующей обработкой сухих хроматограмм реактивом Драгендорфа (оранжевые, оранжево-красные на желтом фоне).
Для обнаружения алкалоидов на БХ используют пары йода (бурые пятна).
Стероидные алкалоиды идентифицируют по кирпично-красному окрашиванию от действия треххлористой сурьмы в хлороформе.
ТСХ на пластинках алюминия оксида может быть использована для качественного и количественного анализа, для разделения алкалоидов различной основности и пространствен-ного строения.
Возможно использование силикагеля КСК и кремниевой кислоты (для хроматографии).
Для любых сорбентов пригодны системы: хлороформ – метиловый спирт – уксусная кислота (18:1:1), (10:3:3); хлороформ – этиловый спирт (9:1), (8:2); ацетон – аммиак (95:5) и (90:10).
Для анализа фармакологически активных алкалоидов часто используют обращенно-фазовое ВЭЖХ разделение на колонке с Zorbax Eclipse XDB-C (5 мкм). В качестве подвижной фазы служит смесь 0.1М фосфорной кислоты и ацетонитрила (85:15, v/v), с использованием УФ-детектора (330 нм); хорошие результаты были также получены при градиентном элюировании смесью 0.005М Na2HPO4 (pH доведен H3PO4 до 6) и ацетонитрила от 80:20 до 20:80 за 20 мин, при использовании УФ детектора (306 нм) [14]. Оптимальным, по мнению немецких ученых, является ВЭЖХ анализ алкалоидов на колонке с Octadecyl-C18 (5 мкм) сорбентом, с использованием в качестве подвижной фазы смеси: метанол – 25% аммиак (10:0.2), при использовании УФ детектора (274 и 337 нм) [15].Убедительные результаты были получены с использованием в качестве неподвижной фазы LiChrospher-100 RP18, (5 мкм). Подвижной фазой служил 70% метанол в 0.01М ацетамиде при pH 8.04 (УФ-детектор 225 нм) [16]. Группой проф. Матсуды (Япония) для разделения и анализа растительных алкалоидов была использована колонка с SS Васкосилом II 5C18 RS (5 мкм). Элюирование проводили смесью ацетонитрила с водой при увеличении содержания ацетонитрила от 26 до 52% в течение 40 минут с использованием УФ-детектора с рабочей длиной волны 280 нм [17].
Количественное определение:
Для выбора методики количественной оценки содержания алкалоидов в сырье предварительно необходима идентификация групповой принадлежности этих соединений по макро-, микродиагностическим признакам сырья и по качественным реакциям, описанным практически для всех групп алкалоидов.
В связи с разнообразием химического строения алкалоидов и их состоянием в сырье, используют различные методы их извлечения. Если алкалоиды присутствуют в виде солей, их можно извлекать водой с последующим переводом в основания под действием аммиака и органического растворителя.
Если алкалоиды присутствуют в виде оснований, их переводят в солеобразное состояние добавлением кислоты, например, хлороводородной с последующим титрованием избытка кислоты натрия гидроксидом.
Гликозидированные формы алкалоидов предварительно гидролизуют добавлением кислот при нагревании.
Ниже приводятся примеры методик на наиболее часто встречающиеся группы алкалоидов как с использованием СО, так и без них.
Метод 1. Около 1 г (точная навеска) измельченного сырья помещают в коническую колбу вместимостью 100 мл, прибавляют 10 мл 25% раствора натрия гидроксида, перемешивают стеклянной палочкой до получения увлажненной массы и оставляют при комнатной температуре на 2 часа. Затем прибавляют 50 мл хлороформа, осторожно перемешивают и оставляют на 30 минут.
Не взмучивая раствора, пипеткой отбирают 15 мл извлечения в делительную воронку вместимостью 100 мл и трижды извлекают алкалоиды 2% раствором кислоты серной порциями 20, 10 и 10 мл до отрицательной реакции с кремневольфрамовой кислотой.
Объединенные кислотные извлечения фильтруют в мерную колбу вместимостью 50 мл, доводят объем раствора до метки 2% раствором кислоты серной и измеряют оптическую плотность при длине волны 420 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения 2% раствор кислоты серной.
Содержание алкалоидов в пересчете на берберина бисульфат в процентах (Х) вычисляют по формуле:
|
15 . 128 . m . (100 - W)
где 50 - объем хлороформного извлечения, в миллилитрах;
50 - объем сернокислотного извлечения, в миллилитрах;
15 - объем хлороформного извлечения, взятого для анализа, в миллилитрах;
D – оптическая плотность сернокислотного извлечения;
128 – удельный показатель поглощения берберина бисульфата при длине волны 420 нм;
W - потеря в массе при высушивании сырья в процентах;
m - масса навески сырья, в граммах [11];
* Возможно использование других СО и других длин волн, например:
646 – удельный показатель поглощения берберина бисульфата при длине волны 345 нм;
434 – удельный показатель поглощения цитизина при длине волны 311 нм (если алкалоиды анализируемого растения содержат или близки по структуре цитизину).
Метод 2. Около 1 г (точная навеска) измельченного сырья или порошка растертых таблеток помещают в коническую колбу, прибавляют 10 мл 2% раствора кислоты лимонной и 30 мл хлороформа, оставляют при перемешивании в течение 1 часа. Хлороформный слой сливают в делительную воронку, а сырье еще раз экстрагируют хлороформом.
Хлороформные извлечения объединяют, обрабатывают 10 мл 1% раствора натрия гидрокарбоната, фильтруют через слой безводного натрия сульфата в мерную колбу вместимостью 50 мл, доводят объем раствора до метки хлороформом и перемешивают.
20 мл полученного хлороформного извлечения помещают в колбу, хлороформ отгоняют досуха при температуре около 400С.
Сухой остаток переносят 4 мл спирта этилового 95% в мерную колбу вместимостью 25 мл, добавляют 2 мл раствора 0.25М кислоты серной, 2 мл свежеприготовленного 0.3% раствора натрия нитрита, выдерживают 30 минут при температуре водяной бани 55±50С.
Раствор охлаждают, добавляют 1 мл свежеприготовленного 5% раствора кислоты сульфаминовой, доводят объем раствора до метки спиртом этиловым 95% и измеряют оптическую плотность раствора при длине волны 390 нм в кювете с толщиной слоя 10 мм.
В качестве раствора сравнения используют раствор из 2 мл 0.25М раствора кислоты серной, 1 мл 5% раствора кислоты сульфаминовой в мерной колбе вместимостью 25 мл с доведенным до метки объемом спиртом этиловым 95%.
Содержание алкалоидов в абсолютно сухом сырье в пересчете на резерпин в процентах (Х) вычисляют по формуле:
|
402 . m . 20 . [(100 - W)]
где D – оптическая плотность испытуемого раствора при длине волны 390 нм;
m - масса навески сырья, в граммах;
(b) – средняя масса препарата (таблетки, драже, капсулы…), в граммах;
402 – удельный показатель поглощения резерпина при длине волны 390 нм;
W - потеря в массе при высушивании сырья в процентах.
Примечания. Приготовление 2% раствора кис-лоты лимонной. 2 г кислоты лимонной растворяют в воде очищенной в мерной колбе вместимостью 100 мл, доводят объем раствора до метки водой очищенной и перемешивают. Раствор годен в течение 6 месяцев.
Приготовление 1% раствора натрия гидро-карбоната. 1 г натрия гидрокарбоната растворяют в воде очищенной в мерной колбе вместимостью 100 мл, доводят объем до метки водой очищенной и перемешивают. Раствор годен в течение месяца.
Приготовление 0,3% раствора натрия нитри-та. 0.3 г натрия нитрита растворяют в воде очищенной в мерной колбе вместимостью 100 мл, доводят объем раствора до метки водой очищенной и перемешивают.
Приготовление 5% раствора кислоты сульфа-миновой. 5 г кислоты сульфаминовой растворяют в воде очищенной в мерной колбе вместимостью 100 мл, доводят объем до метки водой очищенной и перемешивают.
Растворы используют свежеприготовленными.
Приготовление 0.25М раствора кислоты серной. 50 мл 0.5М раствора кислоты серной помещают в мерную колбу вместимостью 100 мл, доводят объем раствора до метки водой очищенной и перемешивают. Раствор годен в течение 6 месяцев.
Метод 3. Около 2 г (точная навеска) измельченного сырья помещают в колбу вместимостью 100 мл, прибавляют 30 мл хлороформа или этилацетата, 5 мл раствора аммиака, выдер-живают с обратным холодильником в течение 1 часа, затем при нагревании на водяной бане при температуре 50-600С в течение 2 часов. Охлаждают, фильтруют и трижды экстрагируют алкалоиды 1% раствором кислоты хлороводородной порциями по 20, 15 и 10 мл.
Кислотные извлечения объединяют, подщелачивают раствором аммиака до щелочной реакции по фенолфталеину и алкалоиды извлекают хлороформом порциями по 20, 15 и 10 мл до отрицательной реакции с реактивом Майера или раствором кислоты кремневольфрамовой.
Объединенные хлороформные извлечения фильтруют через слой прокаленного натрия сульфата и отгоняют досуха на водяной бане. (*)
Сухой остаток растворяют при нагревании на водяной бане в 15 мл 0.02М раствора кислоты хлороводородной, прибавляют 2 капли метиленового красного, 1 каплю метиленового синего и избыток кислоты хлороводородной оттитровывают 0.02М раст-вором натрия гидроксида до появления зеленой окраски. (**)
Содержание алкалоидов а абсолютно сухом сырье в пересчете на гиосциамин в процентах вычисляют по формуле:
|
m . (100 - W)
где V - объем 0.02М раствора натрия гидроксида, израсхо-дованный на титрование, в миллилитрах;
m - масса навески сырья, в граммах;
W - потеря в массе при высушивании сырья в процентах;
0.00578 – количество алкалоидов в пересчете на гиосциамин, соответствующее 1 мл 0.02М раствора кислоты хлороводородной в граммах;
* Методику можно видоизменить: на отмеченной стадии сухой остаток высушивают до постоянного веса и рассчитывают содержание суммы алкалоидов весовым методом от взятой навески с учетом влажности сырья.
** Можно использовать другие СО и, соответственно, использовать другие коэффициенты пересчета, например.
** 0.0122 – количество суммы алкалоидов в пересчете на термопсин, соответствующее 1 мл
0.05М раствора кислоты хлороводородной в граммах [18];
** 0.0244 – количество алкалоидов в пересчете на термопсин, соответствующее 1 мл 0.1н
раствора кислоты хлороводородной в граммах [19].
*** - сухой остаток растворяют в 10 мл кислоты уксусной, прибавляют 2 капли раствора кристаллического фиолетового и титруют 0.02М раствором кислоты перхлорной до изменения окраски на голубую, если в сырье присутствуют алкалоиды типа цитизина, соласодина.
4.09 – количество алкалоидов в пересчете на метилцитизин, соответствующее 1 мл 0.02М раствора кислоты перхлорной, в миллиграммах.
0.04137 – количество алкалоидов в пересчете на соласодин, соответствующее 1 мл 0.1М раствора кислоты хлоро-водородной, в миллиграммах.
Метод 4. (при наличии СО любых алкалоидов). Точную навеску сырья или 5 мл испытуемого раствора (препарата, извлечения или элюата) помещают в мерную колбу на 100 мл, прибавляют 20 мл спирта этилового 95%, перемешивают в течение 15 минут, доводят объем раствора спиртом этиловым 95% до метки, перемешивают.
По 20 мкл испытуемого раствора и раствора СО хроматографируют на жидкостном хроматографе с УФ-детектором получая не менее 5 хроматограмм для каждого раствора в следующих условиях (например):
§ колонка 150х4.6 мм, сорбент Зорбакс, размер частиц 5 мкм или аналогичная;
§ подвижная фаза: ацетонитрил – 0.1М раствор аммония карбоната (55:45), дегазированная любым способом;
§ скорость потока – 1 мл/мин;
§ температура колонки 450С;
§ детектирование при длине волны 225 нм.
Содержание алкалоидов в мг вычисляют по формуле:
|
S0 . m . 5 . [(100 - W)]
где S1 – среднее значение площадей пиков анализируемого раствора соответствующих алкалоидам;
S0 – среднее значение площадей пиков СО алкалоида;
m0 – масса навески СО алкалоида, в миллиграммах;
m – масса навески сырья, в миллиграммах;
W - потеря в массе при высушивании сырья, в процентах;
Р – содержание алкалоида в СО алкалоида, в процентах.
Примечания. Приготовление 0.1М раствора аммония карбоната. 7.8 г аммония карбоната помещают в мерную колбу вместимостью 1 л, растворяют в 700 мл воды очищенной, доводят объем раствора до метки водой очищенной и перемешивают.
Результаты анализа достоверны, если выполняется требова-ние теста «Проверка пригодности хроматографической системы».
Метод 5. Около 5 г (точная навеска) измельченного сырья помещают в аппарат Сокслета или в колбу вместимостью 250 мл, прибавляют 10 мл 8% раствора аммония гидроксида, 50 мл хлороформа и экстрагируют на кипящей водяной бане в течение 3 часов. Хлороформ отгоняют до объема 10-15 мл и количественно переносят в мерную колбу вместимостью 25 мл, доводят объем хлороформом до метки и перемешивают (раствор А).
На хроматографическую пластинку наносят 0.2 мл полученного раствора в виде полосы 4 см. На расстоянии 2 см от испытуемого раствора в качестве свидетеля наносят 0.005 мл 1% раствора СО, например колхамина, пластинку подсушивают на воздухе. Затем помещают в камеру и хроматографируют в системе растворителей хлороформ – спирт метиловый (24:1) восходящим способом.
Хроматограмму просматривают в УФ-свете, отмечая пятно СО и пятно, совпадающее по положению и цвету в анализируемом растворе. Вырезают пятна СО, испытуемого раствора и пустого слоя, помещают в стаканы, элюируют 15% раствором кислоты хлороводородной, отфильтровывают в мерную колбу вместимостью 25 мл, объем элюатов доводят тем же раствором до метки и перемешивают (раствор Б).
Измеряют оптическую плотность полученного раствора при длине волны 364 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения воду очищенную.
Параллельно измеряют оптическую плотность раствора СО.
Содержание алкалоидов в сырье, в пересчете на СО в процентах (Х) вычисляют по формуле:
|
D0 . m . V2 . (100 - W)
где V1 - объем хлороформного извлечения А, в мл;
V2 - объем извлечения А, нанесенного на пластинку, в мл;
V3 - объем раствора Б, в мл;
D1 – оптическая плотность раствора СО при lmax 364 нм;
D0 – оптическая плотность раствора Б при lmax 364 нм;
m - масса навески сырья, в граммах;
W - потеря в массе при высушивании сырья в процентах;
Р – содержание алкалоида в 1 мл раствора СО, в граммах.
* - если СО – колхамин, Р=0.00002 при длине волны 364 нм.
Стрихнин и бруцин. 0.5 г (точная навеска) измельченного в порошок сырья помещают в фарфоровую чашку, прибавляют 10 мл спирта этилового 96%, 1 мл 10% раствора кислоты серной, перемешивают и выпаривают на водяной бане досуха.
После охлаждения к остатку прибавляют 2 мл воды очищенной, 6 г алюминия оксида для хроматографии и заполняют колонку для хроматографии длиной 20-25 см.
Алкалоиды элюируют хлороформом со скоростью 1-2 капли в секунду.
10 мл элюата разбавляют хлороформом в колбе вместимостью 50 мл и измеряют оптическую плотность полученного раствора при длине волны 257 и 304 нм, относительно раствора сравнения – хлороформа.
Содержание стрихнина и бруцина в абсолютно сухом сырье в процентах (Х) рассчитывают по формуле:
|
m . (100 - W)
|
m . (100 - W)
где D257 – оптическая плотность испытуемого раствора при длине волны 257 нм;
D304 – оптическая плотность испытуемого раствора при длине волны 304 нм;
m – масса навески сырья, в граммах;
W - потеря в массе при высушивании сырья в процентах.
Гликоалкалоиды – это производные циклопентанопер-гидрофенантрена, по свойствам аналогичны стероидным сапонинам и алкалоидам.
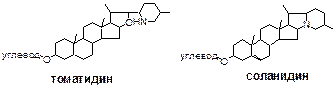 |
В основе их структуры – азотсодержащие аналоги сапонинов или стероидов, например:
Углеводная часть может быть представлена D-глюкозой, D-галактозой, L-рамнозой, L-арабинозой, D-ксилозой, D-глюкуро-новой и D–галактуроновой кислотами.
Гликоалкалоиды – оптически активны, растворимы в горячем спирте, в виде солей растворимы в воде, гидролизуются при нагревании с кислотами.
Для их выделения из растений используют экстракцию разбавленными кислотами с последующим осаждением аммиаком, а также метод твердо-фазной экстракции на колонке Sep-Pak C18, с использованием в качестве подвижной фазы смеси метанол – 0.1М кислота хлороводородная (8:2), после предварительного исчерпывающего элюирования сопутству-ющих веществ водой, аммония бикарбонатом и смесью равных объемов метанола и аммония бикарбоната [20].
Для разделения гликоалкалоидов используют вариант колоночной хроматографии на оксиде алюминия II и III степеней активности, элюируя смесью бензола с хлороформом.
Для разделения и анализа гликоалкалоидов может быть также использован метод ВЭЖХ на колонке с Techsphere 80 C18 сорбентом и использованием в качестве подвижной фазы смеси ацетонитрил - 0.01M солянокислый буфер (40:60 v/v) при pH 7.8 (УФ-детектор, 203 нм) [21].
Гликоалкалоиды осаждаются холестерином, дигитонином, дают окрашивание с п-оксибензальдегидом, анисовым альдегидом, резорцином, формальдегидом [11].
Для проведения качественных реакций сырье заливают 5% раствором уксусной кислоты, взбалтывают в течение 40 минут, фильтруют.
q К 1 мл извлечения добавляют несколько капель 1% спиртового раствора холестерина – гликоалкалоиды выпадают в осадок.
Количественный анализ осуществляют методами титрования кислотой хлороводородной, потенциометрией, весовым и колориметрическим методами [11].
Ниже приведены наиболее воспроизводимые методики анализов.
Метод 1. Около 3 г сырья (точная навеска) помещают в колбу вместимостью 100 мл, прибавляют 50 мл 5% раствора кислоты уксусной, нагревают при перемешивании на кипящей водяной бане в течение 4 часов, охлаждают и фильтруют.
20 мл фильтрата помещают в колбу вместимостью 100 мл, прибавляют 6 мл 25% раствора аммиака, нагревают на кипящей водяной бане в течение 2 часов, быстро охлаждают льдом. При этом сумма алкалоидов осаждается. Осадок отфильтровывают, высушивают на воздухе. Фильтр с осадком гликоалкалоидов помещают в колбу вместимостью 100 мл, прибавляют 30 мл спирта этилового 95% и экстрагируют при нагревании на водяной бане с обратным холодильником 30-40 минут. Экстрагирование повторяют до отрицательной реакции с раствором формальдегида в кислоте серной или с йодом. Спиртовые извлечения отгоняют досуха.
К сухому остатку прибавляют 5-10 мл 1% раствора кислоты уксусной и растворяют гликоалкалоиды при слабом нагревании на водяной бане.
К уксуснокислому раствору гликоалкалоидов прибавляют 5-10 мл 25% раствора аммиака, нагревают до 60-650С, затем охлаждают на льду. Выпавшие гликоалкалоиды отфильтро-вывают через предварительно высушенный фильтр, промывают 1% раствором аммиака до обесцвечивания фильтрата и высушивают в сушильном шкафу при температуре 80-900С до постоянной массы.
Метод 2. Полученный сухой остаток суммы гликоалкало-идов растворяют в 100 мл спирта этилового 95% при нагревании на водяной бане в течение 30-40 минут. При наличии значи-тельного количества гликоалкалоидов экстракцию спиртом повторяют еще 2-3 раза.
Полноту извлечения гликоалкалоидов определяют по отсутствию окрашивания с парами йода или раствором формальдегида в кислоте серной.
Спиртовые извлечения отгоняют досуха, сухой остаток промывают 1% раствором аммиака до его обесцвечивания, высушивают при температуре 80-900С. Сухой остаток растворяют в 100 мл спирта этилового 95% и титруют потенциометрически 0.1н раствором кислоты хлороводородной.
1 мл 0.1н раствора кислоты хлороводородной соответствует 0.04137 г соласодина.
Содержание гликоалкалоидов в процентах (Х) в абсолютно сухом сырье вычисляют по формуле:
|
m . V2 . (100 - W)
где V - объем 0.1н раствора кислоты хлороводородной, израс-ходованной на титрование в миллилитрах;
V1 - объем 5% раствора кислоты уксусной, пошедшей на экстракцию гликоалкалоидов в миллилитрах;
V2 - объем фильтрата, взятый для осаждения гликоалкало-идов аммиаком в миллилитрах;
m - масса навески сырья, в граммах;
W - потеря в массе при высушивании сырья в процентах.
