Многоэлектронные атомы
В многоэлектронном атоме на электрон действует не только сила притяжения со стороны положительного заряженного ядра, но и отталкивание со стороны других электронов. Электроны внутренних электронных уровней атома ослабляют притяжение внешнего электрона ядром – экранируют внешний электрон от ядра. Это экранирование оказывается различным для электронов с разной формой электронного облака. Поэтому в многоэлектронных атомах энергия электрона зависит не только от главного квантового числа, но и от орбитального квантового числа, которое определяет форму электронной орбитали.
Распределение электронов в атоме по уровням и орбиталям происходит в соответствии с принципами Паули, Хунда, наименьших энергий.
Принцип Паули
Принцип (запрет) Паули гласит: в атоме не может быть двух электронов, имеющих одинаковыезначения всех четырех квантовых чисел. Отсюда следует, что на каждой орбитали может быть не более двух электронов, причем они должны иметь антипараллельные спины. Т.е. допускается заполнение
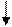
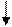






 орбитали следующим образом ; такие варианты , не допускаются.
орбитали следующим образом ; такие варианты , не допускаются.
Правило Гунда
В соответствии с этим правилом заполнение орбиталей данного подуровня происходит таким образом, чтобы достигалось максимальное значение суммарного спинового числа (∑ms). Заполнение электронами р-подуровня (либо любого другого) происходит таким образом, что каждый из них занимает отдельную орбиталь и только когда все орбитали содержат по одному электрону, начинается их «заселение» вторыми электронами. Например,
а) 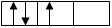 ∑ms = +1/2 – 1/2 + 1/2 = +1/2, т.е. неверный вариант;
∑ms = +1/2 – 1/2 + 1/2 = +1/2, т.е. неверный вариант;
б) 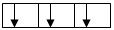 ∑ms = -1/2 – ½ - ½ = - 1½ , т.е. неверный вариант;
∑ms = -1/2 – ½ - ½ = - 1½ , т.е. неверный вариант;
в) 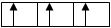 ∑ms = +1/2 + ½ + ½ = +1½ , т.е. единственно верный вариант.
∑ms = +1/2 + ½ + ½ = +1½ , т.е. единственно верный вариант.
Принцип наименьших энергий
Согласно этому принципу электроны заполняют орбитали в порядке повышения уровня энергии орбиталей. В первую очередь заполняются орбитали с наименьшей энергий, т.к. на такой орбитали состояние электрона наиболее стабильно. Возрастание энергии по энергетическим подуровням происходит примерно в следующем порядке:
1s ˂ 2s ˂ 2p ˂ 3s ˂ 3p ˂ 4s ˂ 3d ˂ 4p ˂ 5s ˂ 4d ˂ 5p ˂ 6s ˂ 4f ≈
≈ 5d ˂ 6p ˂ 7s ˂ 5f ≈ 6d ˂ 7p.
При заполнении электронных уровней необходимо учитывать правило В.М. Клечковского: последовательное заполнение электронами подуровней происходит в порядке увеличения суммы главного и побочного квантовых чисел 
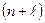 . При одинаковом значении этой суммы для нескольких подуровней, в первую очередь заполняется тот, главное квантовое число которого меньше.
. При одинаковом значении этой суммы для нескольких подуровней, в первую очередь заполняется тот, главное квантовое число которого меньше.
Примеры решения задач
Задача 1.Электронная структура атома описывается формулой
1s2 2s2 2p6 3s2 3p6. Какой это элемент?
Решение. Зная, что порядковый номер элемента в таблице Менделеева численно равен заряду ядра и одновременно общему числу электронов в атоме (т.к. атом частица электронейтральная) для определения элемента необходимо подсчитать число электронов в приведенной формуле. Учитывая, что в обозначении 2p6: 2 – главное квантовое число электронного уровня; р – подуровень, в котором расположены гантелеобразные облака; 6 – число электронов, находящихся на данном подуровне. Подсчитав число электронов на всех подуровнях определяем химическихй элемент. Так как общее число электронов в данном случае равно 18 - следовательно, это аргон.
Задача 2.Определить по правилу Клечковского последовательность заполнения электронных орбиталей, характеризующихся суммой 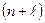 = 6.
= 6.
Решение. Для решения задачи необходимо посчитать суммы главного и побочного квантовых чисел для электронных уровней в диапазоне от n = 1 до
n = 6. Необходимо для каждого главного квантового числа определить побочные квантовые числа и затем их просуммировать.
| n |  | 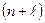 | ||||||||||
| n=1 | ||||||||||||
| n=2 | ||||||||||||
| n=3 | ||||||||||||
| n=4 | ||||||||||||
| n=5 | ||||||||||||
| n=6 | ||||||||||||
| s | p | d | f |
В данном атоме имеется три подуровня, для которых 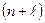 = 6: n=4, n=5, n=6. Учитываем, что в первую очередь заполняется подуровень, главное квантовое число которого меньше. Следовательно, в первую очередь будет заполняться электронами 4d-подуровень, затем 5р-подуровень и в последнюю очередь - 6s-подуровень.
= 6: n=4, n=5, n=6. Учитываем, что в первую очередь заполняется подуровень, главное квантовое число которого меньше. Следовательно, в первую очередь будет заполняться электронами 4d-подуровень, затем 5р-подуровень и в последнюю очередь - 6s-подуровень.
Задача 3. Определите на каком энергетическом уровне находится электрон со следующим набором квантовых чисел: n = 3, 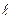 =1,
=1, 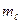 = -1,
= -1,
ms = + 1/2 ? Какую форму имеет орбиталь, внутри которой находятся этот электрон?
Решение. Если n = 3, электрон находится на третьем от ядра атома уровне М. Орбитальное (побочное) квантовое число равное единице соответствует электронному облаку имеющему форму гантели, расположенному по оси «Х» ( 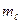 = -1). Вокруг своей оси этот электрон вращается по часовой стрелке, т.к. ms = + ½.
= -1). Вокруг своей оси этот электрон вращается по часовой стрелке, т.к. ms = + ½.
Контрольные задания
1. Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого равно 2? 4?
2. Приведите квантовые числа для всех электронов атома углерода.
3. Какой подуровень заполняется в атомах после 6s-подуровня?
4. Структура валентного электронного слоя атома элемента выражается формулой 3d5 4s1/
5. Приведите электронные и электронно-графические формулы элементов с зарядом ядра а) 17, б) 43, в) 74.
6. На каком основании хром и сера, фосфор и ванадий расположены в одной группе периодической системы? Почему их помещают в разных
подгруппах?
7. Приведите электронные формулы ионов Sn+4, Cr+3, S-2?
8. Чем можно объяснить особую устойчивость электронной конфигурации иона Fe+3?
9. Определить по правилу Клечковского последовательность заполнения электронных подуровней, характеризующихся суммой главного и побочного квантовых чисел 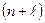 а) 5, б) 7?
а) 5, б) 7?
10. У какого элемента начинает заполняться подуровень 4f? У какого элемента завершается заполнение этого уровня?






