Анализ восстановителей методом перманганатометрии
j 0 MnO4-/ Mn2+ = + 1,51 B
Перманганатометрия является одним из самых доступных и распространенных методов редоксиметрии. Методом перманганатометрии можно анализировать все восстановители, способные окисляться перманганатом калия, стандартные потенциалы которых меньше j 0 MnO4-/Mn2+.
Восстановители в методе перманганатометрии определяют способом прямого титрования.
Аликвоту раствора (объем пипетки) или точно взвешенную и растворенную навеску в определенных условиях титруют стандартным раствором KMnO4 до бледно-розовой окраски.
Но, если восстановители (нитриты и сульфиты) разлагаются в кислой среде, то применяют реверсивное титрование (обратный порядок титрования).
Аликвоту стандартного раствора KMnO4 (объем пипетки) в определенных условиях титруют раствором восстановителя до бледно-розовой окраски.
ПРИМЕРЫ
| H2C2O4×2H2O и ее соли (оксалаты) | j 0 2CO2/C2O42- = - 0,49 B; |
| соли и руды железа: FeSO4×7H2O; соль Мора (NH4)2Fe(SO4)2×6H2O; FeO и др. | j 0 Fe3+/Fe2+ = + 0,77 B; |
| пероксиды: H2O2; Na2O2 | j 0 O2/H2O2 = + 0,68 B; |
| HNO2 и ее соли (нитриты) | j 0 NO3-/NO2- = + 0,94 B; |
| Н2SO3 и ее соли (сульфиты) | j 0 SO42-/ SO32- = + 0,17 B. |
Анализ технической щавелевой кислоты
Способ взятия навески - пипетирование.
Химическая сущность
| j 0 MnO4-/ Mn2+ = + 1,51 B | j 0 2CO2 / C2O42- = - 0,49 B | Dj = 1,51 + 0,49 = 2,00 B |
5H2C2O4 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 8H2O
| MnO4- + 8H+ + 5e- = Mn2+ + 4H2O | |
| H2C2O4 - 2e- = 2CO2 + 2H+ | |
| 2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2 + 8H2O |

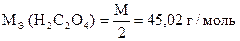

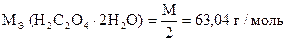

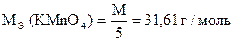
Условия титрования:
· среда сернокислая;
· нагревание щавелевой кислоты ~ t = 80 °C;
· ионы каталитически ускоряют реакцию.
Вначале титруют медленно. Раствор KMnO4 прибавляют по каплям к горячему раствору щавелевой кислоты, следующую каплю KMnO4 прибавляют после обесцвечивания предыдущей капли KMnO4 . Первые капли KMnO4 обесцвечиваются медленно. Далее титруют быстро до бледно-розовой окраски.
По данным титрования вычисляют процентное содержание H2C2O4×2H2O в образце.
Пример расчета
Навеска образца технической щавелевой кислоты 0,3390 г растворена в мерной колбе 100 мл. На титрование 10,00 мл приготовленного раствора расходуется 9,80 мл 0,05062н раствора KMnO4. Вычислить процентное содержание H2C2O4×2H2O в образце.
| Дано: | ||
m н = 0,3390 г Сн (KMnO4) = 0,05062 моль/л Vк = 100,00 мл Vn = 10,00 мл V (KMnO4) = 9,80 мл 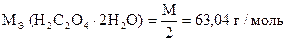 | ||
| w (H2C2O4×2H2O) = ? |
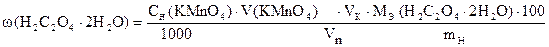
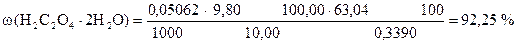
‚ ƒ „ … † ‡
1) Сколько моль-экв KMnO4 содержится в 1 мл раствора.
2) Сколько моль-экв KMnO4 содержится в 9,80 мл раствора.
Столько же моль-экв H2C2O4×2H2O содержится в 10,00 мл раствора.
3) Сколько моль-экв H2C2O4×2H2O содержится в 1 мл раствора.
4) Сколько моль-экв H2C2O4×2H2O содержится в 100,00 мл раствора.
5) Сколько г H2C2O4×2H2O содержится в 100,00 мл раствора.
Столько же г H2C2O4×2H2O содержится в навеске.
6) Сколько г H2C2O4×2H2O содержится в 1 г образца.
7) Сколько г H2C2O4×2H2O содержится в 100 г образца или w (H2C2O4×2H2O).
