Электрохимические методы анализа
1. Для потенциометрических измерений используют:
А. Поляриметры.
В. Кулонометры.
С. Полярографы.
Д. Потенциометры.*
Е. Рефрактометры.
2. Для вольтамперометрических измерений используют:
А. Поляриметры.
В. Кулонометры.
С. Полярографы.*
Д. Потенциометры.
Е. Рефрактометры.
3. Для кулонометрических измерений используют:
А. Поляриметры.
В. Кулонометры.*
С. Полярографы.
Д. Потенциометры.
Е. Рефрактометры.
4. Укажите метод инструментального анализа, в основе которого лежит измерение разности электрических потенциалов, возникающей между индикаторным и стандартным электродами, опущенными в раствор с определяемым веществом:
А. Потенциометрия.*
В. Кулонометрия.
С. Кондуктометрия.
Д. Вольтамперометрия.
Е. Полярография.
5. Укажите метод инструментального анализа, в основе которого лежит зависимость величины тока, протекающего через ячейку, от значения потенциала, приложенного к электродам:
А. Вольтамперометрия.*
В. Кулонометрия.
С. Потенциометрия.
Д. Поляриметрия.
Е. Кондуктометрия.
6. В потенциометрическом методе анализа применяют электроды, различаемые по роду обратимости на электроды первого и второго рода. Укажите электрод первого рода:
А. Ртутный.*
В. Ионоселективный.
С. Хлорсеребряный.
Д. Стеклянный.
Е. Каломельный.
7. В потенциометрическом методе анализа применяют электроды, различаемые по роду обратимости на электроды первого и второго рода. Укажите электрод второго рода:
А. Каломельный.*
В. Серебряный.
С. Ртутный.
Д. Медный.
Е. Платиновый.
8. Значение равновесного потенциала рассчитывают по уравнению:
А. Ильковича.
В. Никольского.
С. Релея.
Д. Нернста.*
Е. Больцмана.
9. Хингидронный электрод является:
А. Переносчиком электронов.
В. Чувствительным к концентрации ионов водорода.*
С. Чувствительным к концентрации катионов.
Д. Чувствительным к концентрации анионов.
10. Платиновый электрод является:
А. Переносчиком электронов.*
В. Чувствительным к концентрации ионов водорода.
С. Чувствительным к концентрации катионов.
Д. Чувствительным к концентрации анионов.
11. Стеклянный электрод является:
А. Переносчиком электронов.
В. Чувствительным к концентрации ионов водорода.*
С. Чувствительным к концентрации катионов.
Д. Чувствительным к концентрации анионов.
12. Сурьмяный электрод является:
А. Переносчиком электронов.
В. Чувствительным к концентрации анионов.
С. Чувствительным к концентрации катионов.
Д. Чувствительным к концентрации ионов водорода.*
13. Укажите индикаторный электрод для проведения потенциометрического окислительно-восстановительного титрования:
А. Платиновый.*
В. Ртутный.
С. Стеклянный.
Д. Водородный.
Е. Хингидронный.
14. Интегральная кривая потенциометрического титрования представляет собой графическое изображение:
А. Функции потенциала от объема титранта.*
В. Функции отношения ∆Е/∆V от объема титранта.
С. Функции отношения V/∆Е от объема титранта.
Д. Функции отношения ∆2Е/∆V2 от объема титранта.
Е. Функции отношения ∆Е2/∆V от объема титранта.
15. Дифференциальная кривая потенциометрического титрования может представлять собой графическое изображение:
А. Функции отношения ∆Е/∆V от объема титранта.*
В. Функции потенциала от объема титранта.
С. Функции отношения V/∆Е от объема титранта.
Д. Функции отношения Е/V от объема титранта.
Е. Функции отношения ∆Е2/∆V от объема титранта.
16. Дифференциальная кривая потенциометрического титрования может представлять собой графическое изображение:
А. Функции отношения ∆Е/V от объема титранта.
В. Функции потенциала от объема титранта.
С. Функции отношения V/∆Е от объема титранта.
Д. Функции отношения ∆2Е/∆V2 от объема титранта.*
Е. Функции отношения ∆Е2/∆V от объема титранта.
17. Кривая потенциометрического титрования по методу Грана представляет собой графическое изображение:
А. Функции отношения ∆Е/∆V от объема титранта.
В. Функции потенциала от объема титранта.
С. Функции отношения ∆V/∆Е от объема титранта.*
Д. Функции отношения ∆Е2/∆V2 от объема титранта.
Е. Функции отношения ∆Е2/∆V от объема титранта.
18. Укажите метод, основанный на измерении электропроводности анализируемых растворов, изменяющейся в результате химических реакций:
А. Кондуктометрия.*
В. Потенциометрия.
С. Полярография.
Д. Кулонометрия.
Е. Амперометрия.
19. Укажите метод анализа, основанный на измерении количества электричества, израсходованного на электролиз определенного количества вещества:
А. Кулонометрия.*
В. Амперометрия.
С. Потенциометрия.
Д. Полярография.
Е. Кондуктометрия.
20. Укажите метод анализа, основанный на использовании зависимости силы тока, протекающего при электролизе раствора, от концентрации электродноактивных веществ в анализируемом растворе:
А. Кулонометрия.
В. Амперометрия.
С. Потенциометрия.
Д. Полярография.*
Е. Кондуктометрия.
21. Укажите основное требование, предъявляемое к индикаторным электрохимическим реакциям:
А. Замена одной индикаторной реакции, протекающей до точки эквивалентности, другой, протекающей после точки эквивалентности.*
В. Достаточная скорость реакции.
С. Стехиометричность.
Д. Необратимость.
Е. Возможность фиксирования точки конца титрования.
22. Дифференцированное определение I- и Cl--ионов в их смеси проводят титрованием 0,05 М стандартным раствором нитрата серебра с серебряным индикаторным электродом. Укажите электрод, используемый в качестве электрода сравнения:
А. Насыщенный каломельный электрод.*
В. Хингидронный.
С. Платиновый.
Д. Стеклянный.
Е. Ртутный.
23. Приготовили формиатный буферный раствор и определили рН с помощью иономера ЭВ-74. В качестве индикаторного электрода использовали:
А. Стеклянный.*
В. Каломельный.
С. Серебряный.
Д. Платиновый.
Е. Хлорсеребряный.
24. При определении рН раствора в качестве индикаторного электрода применяют:
А. Стеклянный.*
В. Платиновый.
С. Ртутный.
Д. Хлорсеребряный.
Е. Медный.
25. При аргентометрическом титровании бромидов с потенциометрическим фиксированием точки конца титрования в качестве индикаторного электрода применяют:
А. Серебряный.*
В. Хлорсеребряный.
С. Ртутный.
Д. Стеклянный.
Е. Хингидронный.
26. При потенциометрическом титровании сульфата железа стандартным раствором перманганата калия в качестве индикаторного электрода применяют:
А. Платиновый.*
В. Каломельный.
С. Водородный.
Д. Стеклянный.
Е. Хингидронный.
27. Указать из каких электродов следует составить гальванический элемент для потенциометрического титрования с использованием реакций кислотно-основного взаимодействия:
А. Платиновый и каломельный.
В. Каломельный и хлорсеребрянный.
С. Водородный и сурьмяный.
Д. Стеклянный и хлорсеребрянный.*
Е. Водородный и хингидронный.
28. Указать из каких электродов следует составить гальванический элемент для потенциометрического титрования с использованием реакций окислительно-восстановительного взаимодействия:
А. Платиновый и хлорсеребряный.*
В. Каломельный и хлорсеребрянный.
С. Серебряный и платиновый.
Д. Стеклянный и хлорсеребрянный.
Е. Платиновый и хингидронный.
29. Указать из каких электродов следует составить гальванический элемент для потенциометрического титрования с использованием реакций осаждения:
А. Платиновый и каломельный.
В. Каломельный и хлорсеребрянный.
С. Водородный и хлорсеребряный.
Д. Серебряный и хлорсеребрянный.*
Е. Водородный и каломельный.
30. Взаимосвязь между количеством электричества, протекающего через раствор, и массой вещества, выделяющегося при электролизе, устанавливается законом:
А. Вавилова.
В. Стокса-Ломмеля.
С. Снеллиуса.
Д. Бернара.
Е. Фарадея.*
31. Определение конечной точки титрования в кулонометрии можно проводить:
А. Индикаторным способом.
В. Спектрофотометрически.
С. Электрохимически.
Д. Всеми перечисленными способами.*
32. Прямая кулонометрия применяется для определения:
А. Электроактивных веществ.*
В. Электронеактивных веществ.
С. И тех, и других.
Д. Ни тех, ни других.
33. Кулонометрическое титрование применяется для определения:
А. Электроактивных веществ.
В. Электронеактивных веществ.
С. И тех, и других.*
Д. Ни тех, ни других.
34. При кулонометрическом титровании кислот используют следующую реакцию, протекающую на генераторном электроде:
А. 2Н2О + 2ē ↔ 2ОН- + Н2*
В. Н2О ↔ 2Н+ + ½О2 + 2ē
С. 2Br- ↔ Br2 + 2ē
Д. 2I- ↔ I2 + 2ē
E. Ag ↔ Ag+ + ē
35. При кулонометрическом титровании оснований используют следующую реакцию, протекающую на генераторном электроде:
А. 2Н2О + 2ē ↔ 2ОН- + Н2
В. Н2О ↔ 2Н+ + ½О2 + 2ē*
С. 2Br- ↔ Br2 + 2ē
Д. 2I- ↔ I2 + 2ē
E. Ag ↔ Ag+ + ē
36. При кулонометрическом титровании галогенидов используют следующую реакцию, протекающую на генераторном электроде:
А. 2Н2О + 2ē ↔ 2ОН- + Н2
В. Н2О ↔ 2Н+ + ½О2 + 2ē
С. 2Br- ↔ Br2 + 2ē
Д. 2I- ↔ I2 + 2ē
E. Ag ↔ Ag+ + ē*
37. При кулонометрическом титровании фенолов используют следующую реакцию, протекающую на генераторном электроде:
А. 2Н2О + 2ē ↔ 2ОН- + Н2
В. Н2О ↔ 2Н+ + ½О2 + 2ē
С. 2Br- ↔ Br2 + 2ē*
Д. 2I- ↔ I2 + 2ē
E. Ag ↔ Ag+ + ē
38. При кулонометрическом титровании тиосульфата натрия используют следующую реакцию, протекающую на генераторном электроде:
А. 2Н2О + 2ē ↔ 2ОН- + Н2
В. Н2О ↔ 2Н+ + ½О2 + 2ē
С. 2Br- ↔ Br2 + 2ē
Д. 2I- ↔ I2 + 2ē*
E. Ag ↔ Ag+ + ē
39. Какой из электрохимических методов титрования позволяет исключить стандартизацию титранта:
А. Амперометрический.
В. Потенциометрический.
С. Кулонометрический.*
Д. Кондуктометрический.
Е. Никакой из перечисленных.
40. Основными условиями проведения кулонометрического титрования являются:
А. Избыток вспомогательного реагента (~1000-кратный).
В. Величина постоянного тока должна быть меньше величины диффузного тока вспомогательного реагента во избежание протекания реакции с участием фонового электролита.
С. Точно фиксировать начало и конец отсчета времени.
Д. Точно фиксировать величину силы тока.
Е. Все перечисленные.*
41. Для получения электрогенерированных титрантов в кулонометрии можно использовать:
А. Растворитель.
В. Введенный реагент.
С. Материал генераторного электрода.
Д. Все перечисленное.*
42. Удельная электропроводность зависит от:
А. Природы электролита.
В. Природы растворителя.
С. Концентрации раствора.
Д. Температуры.
Е. Всего перечисленного.*
43. В прямой кондуктометрии концентрацию вещества в анализируемом растворе определяют по результатам измерений:
А. Удельной электропроводности.*
В. Эквивалентной электропроводности.
С. Удельной теплоемкости.
Д. Удельного сопротивления.
Е. Величины потенциала.
44. В кондуктометрическом титровании можно использовать следующие типы реакций:
А. Кислотно-основные.
В. Окислительно-восстановительные.
С. Осадительные.
Д. Комплексообразовательный.
Е. Все перечисленные.*
45. При проведении полярографического анализа используют следующие два параметры, получаемые при рассмотрении полярограмм:
А. Остаточный ток и предельный ток.
В. Потенциал полуволны и потенциал выделения.
С. Потенциал полуволны и диффузный ток.*
Д. Предельный ток и высоту полярографической волны.
Е. Потенциал выделения и диффузный ток.
46. При проведении полярографического анализа используют зависимость от концентрации анализируемого раствора следующего параметра полярограммы:
А. Остаточный ток.
В. Потенциал полуволны.
С. Диффузный ток.*
Д. Предельный ток.
Е. Потенциал выделения.
47. При нахождении концентрации определяемого вещества в полярографическом анализе методом добавок стандарта используют формулу:
А. 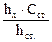
В. 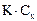
С. 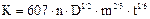
Д. 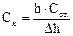 *
*
Е. 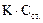
48. При нахождении концентрации определяемого вещества в полярографическом анализе методом стандартных растворов используют формулу:
А. 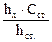 *
*
В. 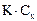
С. 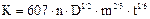
Д. 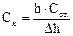
Е. 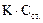
49. При проведении полярографического анализа следует соблюдать следующие условия:
А. Введение фонового электролита.
В. Удаление кислорода, растворенного в анализируемом растворе.
С. Термостатирование полярографической ячейки.
Д. Концентрация фонового электролита должна быть выше концентрации полярографически активного вещества не менее чем в 100 раз.
Е. Все перечисленные.*
50. Недостатком метода полярографии является:
А. Возможность определения нескольких веществ в смеси без предварительного разделения.
В. Погрешность анализа + 2%.
С. Возможность анализа окрашенных растворов.
Д. Чувствительность метода 10-5 - 10-6.
Е. Токсичность и легкая окисляемость ртути в присутствии вещест-окислителей.*
51. Для проведения амперометрического титрования не используют следующие химические реакции:
А. Осадительные.
В. Окислительно-восстановительные.
С. Комплексообразовательные.
Д. Кислотно-основные.*
