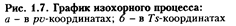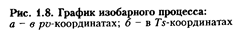Методы исследования термодинамических процессов. энтропия газов
При исследовании все процессы рассматриваются как равновесные и обратимые.
Прежде чем рассматривать порядок исследования термодинамических процессов, введем пятый параметр состояния газа - энтропию S. Энтропия характеризует направления протекания теплообмена между системой и внешней средой.
Для произвольной массы газа G (кг) энтропию S измеряют в кДж/K, а энтропию 1 кг газа обозначают буквой s и измеряют в кДж/(кг • К), т.е. в тех же единицах, что и массовую теплоемкость.
В термодинамике определяют лишь изменение энтропии ΔS =S  – S
– S  . В связи с этим условно считают, что при 0 °C и при любом давлении энтропия S, так же как и внутренняя энергия и, равна нулю.
. В связи с этим условно считают, что при 0 °C и при любом давлении энтропия S, так же как и внутренняя энергия и, равна нулю.
Не прибегая к помощи высшей математики, для произвольного (политропного) термодинамического процесса можно записать:

где ΔQ - количество теплоты, участвующей в произвольном элементарном термодинамическом процессе, кДж/кг;
ΔS - изменение энтропии в данном элементарном процессе, кДж/(кг∙К).
Отношение Δq/T называется приведенной теплотой и представляет собой качественную характеристику процесса преобразования теплоты.
Изменение энтропии как функции состояния зависит не от пути протекания процесса (т.е. пути перехода рабочего тела), а от начального и конечного состояния,
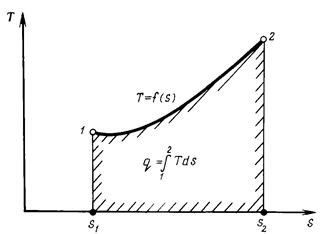
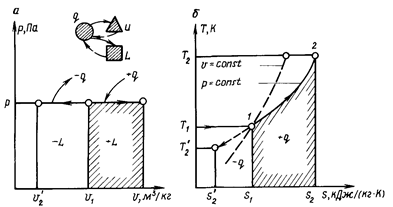
Введение понятия энтропии как параметра состояния рабочего тела позволяет применить для исследования термодинамических процессов новую (pv-диаграмма введена ранее) прямоугольную систему координат Т, s, в которой по оси абсцисс в соответствующем масштабе откладывают энтропию s, а по оси ординат - абсолютную температуру Т. Такая диаграмма называется Ts-диаграммой (рис. 1.6).
В этой диаграмме площадь, ограниченная перпендикулярами, опущенными на ось абсцисс из точек начального и конечного состояний, и осью абсцисс, выражает количество сообщенной или отнятой теплоты q. Поэтому Ts-диаграмму называют также тепловой или энтропийной. Так как в уравнении (1.54) температура T - величина всегда положительная, то Δs и Δq имеют одинаковые знаки, т.е. если теплота q подводится к газу (величина положительная), то и ΔS возрастает. И наоборот, если ΔQ отводится (величина отрицательная), то и ΔS уменьшается. Это одно из наиболее важных свойств энтропии.

При исследовании термодинамических процессов определяют:
1) уравнение процесса и его графическое изображение в системе координат p, v,
2) связь между основными параметрами состояния газа;
3) изменение внутренней энергии газа Δu и величину работы расширения l;
4) количество теплоты q, сообщаемой газу или отводимой от него;
5) графическое изображение процесса в системе координат T, s.
ИЗОХОРНЫЙ ПРОЦЕСС
Процесс, протекающий при постоянном объеме, называется изохорным. Изохорный процесс применяется, в частности, при расчетах теоретических циклов карбюраторных двигателей внутреннего сгорания (ДВС). Уравнение процесса

|
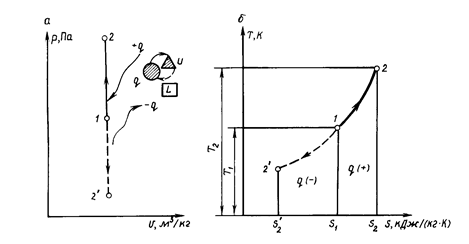
В pv-анаграмме (рис. 1.7) графиком процесса является прямая линия, перпендикулярная оси абсцисс и называемая изохорой.
При неизменном объеме Δυ = 0 площадь, соответствующая в ρυ-диаграмме работе расширения l, также равна нулю. Следовательно, в изохорном процессе работа расширения газа l = 0.
Зависимость между изменяющимися параметрами газа определяется из уравнения (1.13), записанного для начального l и конечного 2 (см. рис. 1.7, а) состояний:

Разделив почленно, получим

Уравнение (1.56) показывает, что в изохорном процессе давление газа прямо пропорционально абсолютной температуре.
Поскольку в данном процессе l = 0, то согласно формуле (1.48) подводимая к рабочему телу теплота q полностью расходуется на изменение внутренней энергии:
q = и, - и, = ^u =с„(Г, - Т.). (1.58)
В процессе 1-2' (см. рис. 1.7, а) теплота q отводится от газа, в результате чего снижается его температура. Следовательно, процесс 1 - 2' - охлаждение рабочего тела (- q).
Изменение удельной энтропии ΔS = S  – S
– S  , в изохорном процессе (при постоянной теплоемкости C
, в изохорном процессе (при постоянной теплоемкости C 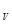 ) подсчитывают по формуле
) подсчитывают по формуле
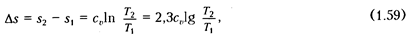
где ΔS - изменение энтропии газа, кДж/(кг • К); C 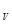 - средняя массовая теплоемкость газа в процессе при v = idem; T
- средняя массовая теплоемкость газа в процессе при v = idem; T 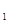 , T
, T  ; -температура соответственно в начале и конце процесса, К.
; -температура соответственно в начале и конце процесса, К.
Уравнение (1.59) показывает, что изохорный процесс изображается в координатах Т, s логарифмической кривой (см. рис. 1.7, б) и протекает так, что при подводе теплоты (+ q) увеличиваются энтропия и температура газа, а при отводе теплоты (- q) эта параметры уменьшаются.
ИЗОБАРНЫЙ ПРОЦЕСС
Процесс, протекающий при постоянном давлении, называется изобарным. Такой термодинамический процесс может протекать в цилиндре, поршень которого перемещается без трения, так что давление в цилиндре постоянно и равно давлению на поршень окружающей среды.
В pv-диаграмме (рис. 1.8) изобара изображается прямой линией, параллельной оси абсцисс (оси удельных объемов v):
1 - 2 - с подводом теплоты (+ q) и 1 - 2' - с отводом теплоты
(-q).
Уравнение процесса

Зависимость между переменными значениями основных
|
параметров состояния рабочего тела определяют из уравнения Клапейрона (1.13), записанного для точек 1 и 2:

откуда получают

Таким образом, при увеличении удельного объема газа в изобарном процессе температура его повышается, при уменьшении - понижается.
Работа расширения газа l (см. рис. 1.8, а) изображается площадью под линией процесса 1 - 2 - расширение (+ l) и под линией 1 - 2' - сжатие (- l). Из рис. 1.8, а видно, что работу расширения можно определить по уравнению

Если количество газа обозначить G (кг), то формула для вычисления работы расширения L принимает вид
L =p(V,- V.) = GR(T,-T,). (1.64)
Приняв в формуле (1.63) разность абсолютных температур T  – Т
– Т  = 1 К, получим, что l = R. Это позволяет определить физический смысл газовой постоянной как удельной работы расширения 1 кг идеального газа при нагревании на 1 К при p = idem.
= 1 К, получим, что l = R. Это позволяет определить физический смысл газовой постоянной как удельной работы расширения 1 кг идеального газа при нагревании на 1 К при p = idem.
Изменение внутренней энергии идеального газа при известных значениях температур в начале (Т 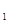 ) и конце (T
) и конце (T 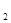 ) процесса (считая теплоемкость C
) процесса (считая теплоемкость C 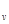 постоянной) выражается уравнением
постоянной) выражается уравнением

Количество теплоты, сообщенной рабочему телу в данном процессе, определяется из математического выражения первого закона термодинамически (1.48) с учетом формул (1.63) и (1.65):
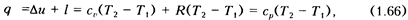
так как согласно формуле (1.30) С 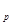 =
= 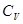 + R.
+ R.
Изменение удельной энтропии в изобарном процессе подсчитывается по уравнению
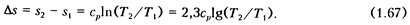
Следовательно, в Ts-диаграмме изобарный процесс, так же как и изохорный, изображается логарифмической кривой, но более пологой по сравнению с изохорой (см. рис. 1.8, б). Такое относительное расположение изобары и изохоры в Ts-диаграмме обусловлено тем, что удельная теплоемкость С 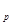 >
> 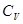 .
.
Количество теплоты процесса q графически изображается площадью (см. рис. 1.8, б), ограниченной кривой процесса (1 - 2, 1 - 2' ) и осью абсцисс.
ЭНТАЛЬПИЯ ГАЗА
В процессах, связанных с расчетом котельных установок, паровых турбин, а также с сушкой и охлаждением сельскохозяйственной продукции, используют параметр состояния рабочего тела (газа), называемый энтальпией - теплосодержанием. Удельная энтальпия обозначается h и измеряется в кДж/кг. Введение понятия "энтальпия" дополнительно к ранее рассмотренным (давление, удельный объем, температура, внутренняя энергия, энтропия) р, v, Т, и, s облегчает исследование процессов в тепловых двигателях, особенно в паровых турбинах.
Этот параметр состояния равен

Если в (1.68) подставить вместо и и pv их значения, а именно и = c 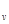 Т и pv = RT, получим
Т и pv = RT, получим

Следовательно, энтальпия идеального газа численно равна произведению массовой теплоемкости при постоянном давлении на абсолютную температуру. Понятию "энтальпия" можно дать следующее пояснение. Пусть в цилиндре под поршнем находится 1 кг газа. На поршень сверху положен груз массой G, уравновешивающий давление газа р.
Очевидно,

где F - площадь поршня.
Вся система находится в равновесии. В этом случае энергия системы (1 кг газа и груз) будет равна внутренней энергии газа и и потенциальной энергии груза массой G, поднятого на высоту H, равную высоте цилиндра:

Так как FH = и (т.е. объему 1 кг газа в цилиндре), то полная энергия системы равна и + pv = h - величине энтальпии газа.
В теплотехнических расчетах обычно требуется знать изменение энтальпии
(Δh = h 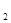 – h
– h 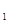 ), а не ее абсолютное значение. Поэтому начало отсчета
), а не ее абсолютное значение. Поэтому начало отсчета
(0 К или 0 °С) для конечного результата (Δh) значения не имеет.
Используя формулу (1.48), нетрудно доказать, что для любого газа в процессе при постоянном давлении (изобарном, р = idem) подводимая теплота равна разности энтальпии в конце и начале процесса:
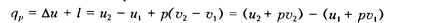
или с учетом (1.68)

Следовательно, в изобарном процессе количество подведенной теплоты 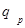 определяется разностью энтальпии в конце (h
определяется разностью энтальпии в конце (h 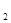 ) и начале (h
) и начале (h 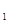 ) процесса.
) процесса.