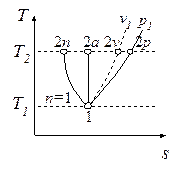Изотермический процесс
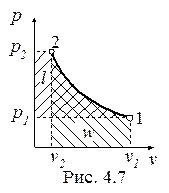 Дано: параметры начального состояния p1, v1, давление конечного состояния p2 (p2 > p1).
Дано: параметры начального состояния p1, v1, давление конечного состояния p2 (p2 > p1).
Определить: недостающие термические параметры T1 и v2, работу и теплоту процесса (w, l, q).
Изотермический процесс, построенный на основании исходных данных (p1, v1, p2) в диаграммах p-v и T-s, представлен на рис. 4.7 и 4.8.
Из уравнения состояния для точки 1 определяет-
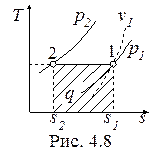 ся температура T = p1.v1/R. Сравнение уравнений состояния для точек 1 и 2 при условии T1 = T2 = T = const (p1.v1 = RT, p2.v2 = RT) дает связь между давлением и объемом в изотермическом процессе:
ся температура T = p1.v1/R. Сравнение уравнений состояния для точек 1 и 2 при условии T1 = T2 = T = const (p1.v1 = RT, p2.v2 = RT) дает связь между давлением и объемом в изотермическом процессе:
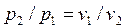 , , | (4.38) |
из которой можно определить удельный объем v2.
Формулы для расчета работы и теплоты изотермического процесса получены на основании уравнений:
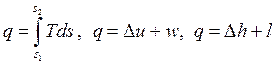 . . |
Для идеального газа при T = const имеем
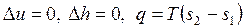 , , | (4.39) |
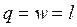 , , | (4.40) |
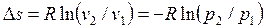 . . |
Для расчета теплоты (работы) изотермического процесса можно использовать формулы
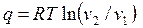 , , | (4.41) |
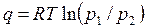 . . | (4.42) |
Работа и теплота изотермического процесса в p-v- и T-s- диаграммах представлена заштрихованными площадями. Равенство работ w и l подтверждается симметрией изотермы относительно осей координат. Работа процесса w < 0, т.к. v2 < v1; работа l < 0, поскольку p2 > p1; теплота отводится (q < 0), т.к. s2 < s1.
Адиабатный процесс
Адиабатным называется процесс, который протекает без теплообмена с окружающей средой (dq = 0).
В обратимых адиабатных процессах энтропия не изменяется (ds = 0,
s = const), в необратимых - энтропия увеличивается (ds > 0).
Уравнение обратимого адиабатного процесса имеет вид
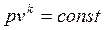 , , | (4.43) |
где k – показатель адиабаты.
Для идеального газа
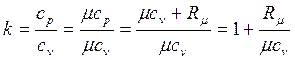 . . | (4.44) |
Для одноатомного идеального газа показатель адиабаты не зависит от температуры:
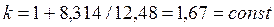 . . |
Для двух-, трех- и многоатомных идеальных газов k = f(T), т.к. теплоемкость mcv =f(T). С увеличением температуры показатель адиабаты убывает.
Если принять теплоемкость постоянной в соответствии молекулярно-кинетической теорией газов, то для двухатомных газов
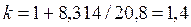 , , |
для трех- и многоатомных газов:
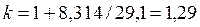 . . |
Расчет адиабатных процессов двух-, трех- и многоатомных газов при значениях показателя адиабаты 1,4; 1,29 является приближенным, т.к. не учитывает зависимость теплоемкости от температуры.
Совместное решение (4.43) с уравнением состояния идеального газа
pv = RT дает следующие связи параметров:
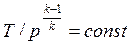 , , | (4.45) |
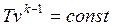 . . | (4.46) |
Для адиабатного процесса 1-2, в котором параметры изменяются от p1, v1, T1 до p2, v2, T2, на основании уравнений (4.43), (4.45), (4.46) можно получить следующие соотношения между параметрами:
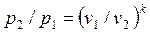 , , | (4.47) |
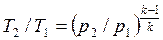 , , | (4.48) |
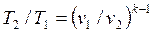 . . | (4.49) |
Совместное решение уравнений
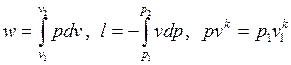
позволяет получить расчетные формулы для работы адиабатного процесса
1-2:
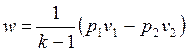 , , | (4.50) |
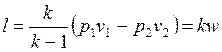 . . | (4.51) |
С учетом уравнения состояния pv = RT, а также соотношения (4.48) формулу (4.50) можно представить следующим образом:
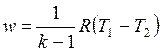 , , | (4.52) |
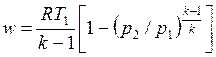 . . | (4.53) |
По формулам (4.46) - (4.53) производят расчеты адиабатных процессов одноатомного идеального газа и приближенные расчеты двух-, трех- и многоатомных газов при значениях k = 1,4, k = 1,29.
Расчет адиабатных процессов с учетом зависимости k = f(T) по вышеприведенным формулам прост, если известны температуры T1 и T2. В противном случае используется метод последовательных приближений, что значительно усложняет расчет.
Более простым является табличный метод расчета адиабатного процесса идеального газа с учетом зависимости теплоемкости от температуры. В основе расчета лежат следующие уравнения:
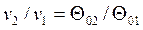 , , | (4.54) |
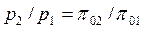 , , | (4.55) |
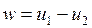 , , | (4.56) |
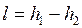 . . | (4.57) |
Здесь 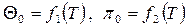 - безразмерные величины, приведенные в таблицах термодинамических свойств газов [7], h, u - табличные значения параметров.
- безразмерные величины, приведенные в таблицах термодинамических свойств газов [7], h, u - табличные значения параметров.
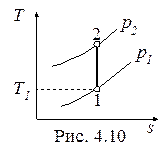
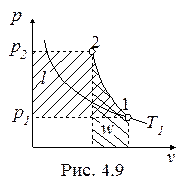 |
Обратимый адиабатный процесссжатия идеального газа, построенный по исходным параметрам p1, T1, p2 в p-v- и T-s- диаграммах, представлен на рис.4.9 и 4.10.
В p-v- диаграмме адиабата - несимметричная гипербола располагается круче изотермы, в T-s- диаграмме – изоэнтропа (s = const, q = 0).
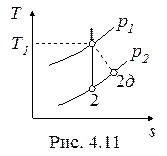 | 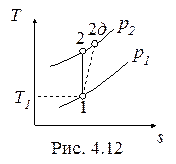 | ||
Необратимые адиабатные процессы (1-2д), протекающие с увеличением энтропии, показаны на рис. 4.11, 4.12.
Работа необратимого адиабатного расширения (рис.4.11) равна
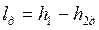 , , |
и она меньше работы обратимого процесса, вычисляемого по формуле
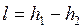 . . |
Напротив, работа необратимого адиабатного сжатия (рис. 4.12), равная
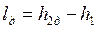 , , |
больше работы обратимого процесса
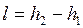 . . |
Политропные процессы
Политропные процессы описываются уравнением
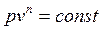 , , | (4.58) |
где n – показатель политропы, который не зависит от температуры (n = const) и изменяется в пределах от -µ до µ.
Внешняя схожесть уравнений (4.43) и (4.58) позволяет записать расчетные формулы политропного процесса, аналогичные адиабатному:
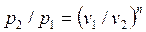 , , | (4.59) |
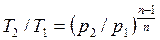 , , | (4.60) |
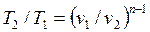 , , | (4.61) |
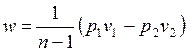 , , | (4.62) |
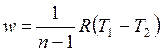 , , | (4.63) |
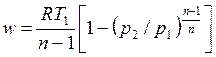 , , | (4.64) |
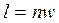 . . | (4.65) |
Теплота политропного процесса рассчитывается по уравнению
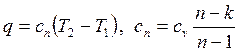 , , | (4.66) |
где cn – теплоемкость политропного процесса.
Все многообразие процессов можно описать политропой с показателем -µ < n < µ. Изохорный, изобарный, изотермический, адиабатный процессы являются частным случаем политропных процессов с определенным показателем n. Подставляя конкретные его значения в формулы (4.58) и (4.66), можно доказать, что при:
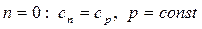 - процесс изобарный;
- процесс изобарный;
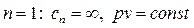 - процесс изотермический;
- процесс изотермический;
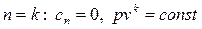 - процесс адиабатный;
- процесс адиабатный;
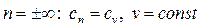 - процесс изохорный.
- процесс изохорный.
На рис. 4.13 и 4.14 в p-v- и T-s- диаграммах представлено все множество политропных процессов с показателем n, изменяющиxся от -µ до µ.
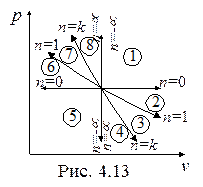 | 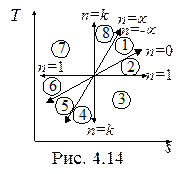 | ||
Можно выделить следующие группы процессов:
1. Процессы расширения (dv > 0, dw > 0)- области 1, 2, 3, 4.
2. Процессы сжатия (dv < 0, dw < 0) – области 5, 6, 7, 8.
3. Процессы подвода теплоты (ds > 0, dq > 0) – области 8, 1, 2, 3.
4. Процессы отвода теплоты (ds < 0, dq < 0) - области 4, 5, 6, 7.
5. Процессы, протекающие с увеличением температуры (dT > 0, du > 0, dh > 0) - области 7, 8, 1, 2.
6. Процессы, протекающие с уменьшением температуры (dT < 0, du < 0, dh <0) - области 3, 4, 5, 6.
7. Процессы с отрицательной теплоемкостью (cn < 0, 1 < n < k) - области 3, 7.
В области 3 при подводе теплоты (dq > 0) температура, внутренняя энергия, энтальпия уменьшаются (dT < 0, du < 0, dh < 0). В области 7 при отводе теплоты (dq < 0) температура, внутренняя энергия, энтальпия увеличиваются (dT > 0, du > 0, dh > 0). Это может быть только при отрицательной теплоемкости. В процессах с отрицательной теплоемкостью 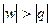 , поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела, а затрачиваемая работа на сжатие компенсирует не только отводимую теплоту, но и повышает внутреннюю энергию рабочего тела.
, поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела, а затрачиваемая работа на сжатие компенсирует не только отводимую теплоту, но и повышает внутреннюю энергию рабочего тела.
При изображении политропных процессов в диаграммах p-v и T-s необходимо определить область, к которой они принадлежат, путем сравнения показателя политропы с n = k, n =1 и т.д.
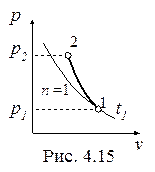 | 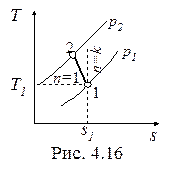 | ||
Политропный процесс газа с показателем 1<n<k, построенный по исходным параметрам p1, t1, p2 (p2 > p1) в p-v- и T-s- диаграммах представлен на рис. 4.15 и 4.16.
В p-v- диаграмме политропа – несимметричная гипербола, которая располагается круче изотермы, т.к. n >1.
В T-s- диаграмме политропа - логарифмическая кривая, которая располагается между изотермой и изоэнтропой, т.к. 1< n < k.
Методические указания
При расчетах изменения калорических параметров (Du, Dh, Ds), теплоты и работы в процессах идеального газа в одних случаях допускается подставлять температуру как в градусах Цельсия, так и в градусах Кельвина, например 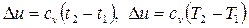 , в других - только в градусах Кельвина, например
, в других - только в градусах Кельвина, например
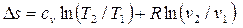 .
.
В одних величинах допускается при записи размерности использовать как градусы Цельсия (0С), так и градусы Кельвина (К), например, удельной теплоемкости,
с, Дж/(кг.0С), или с, Дж/(кг.К),
в других - только градусы Кельвина, например, удельной газовой постоянной и энтропии,
R, Дж/(кг.К), s, Дж/(кг.К).
Почему это так?
Дифференцирование связи температур
T = t + 273,15
дает dT = dt, т.е. разность температур в абсолютной шкале и в стоградусной шкале одна и та же. Это значит, что цена одного градуса в обеих шкалах одинакова. Следовательно, когда речь идет о разности температур, правомерно использовать любые градусы:
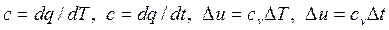 .
.
В тех случаях, когда речь идет о температуре или об отношении температур,
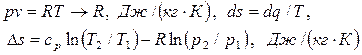
температура подставляется только в градусах Кельвина.
Задачи
1. При сжатии в компрессоре параметры воздуха изменились от p1 =1 бар, t1 = 20 0С, до p2 = 6 бар , t2 = 440 0С. Рассчитайте изменение энтальпии (Dh), внутренней энергии (Du), энтропии (Ds):
а) используя таблицы термодинамических свойств газов [7]; таблица для воздуха дана в Приложении.
б) при постоянной теплоемкости, принятой согласно молекулярно-кинетической теории газов.
2. Рассчитайте изменение энтальпии воздуха при нагреве его от 0 до
300 0С:
а) используя формулу зависимости теплоемкости от температуры для воздуха
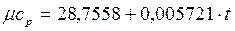 , кДж/(кмоль.0С);
, кДж/(кмоль.0С);
б) используя табличные значения средних теплоемкостей cpm (см. Приложение).
3. Рассчитайте эксергию потока гелия с параметрами p= 6 бар, t = 400 0С. Параметры окружающей среды: toc = 20 0С, poc = 1 бар. Мольная масса гелия m = 4 кг/кмоль.
Решение
Эксергия потока гелия
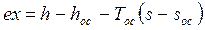 .
.
Поскольку гелий - одноатомный газ, его теплоемкость постоянна и равна:
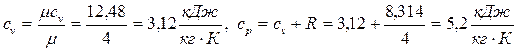 .
.
Тогда
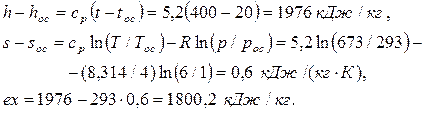
Ответ: ex= 1800,2 кДж/кг.
4. Параметры воздуха изменились от p1 = 1 бар, t1 = 0 0С до t2 = 200 0С:
а) в изобарном процессе;
б) в изохорном;
в) в адиабатном;
г) в политропном с показателем n = 1,2.
Определите для каждого из процессов показатель политропы (n), теплоемкость (c), изменение энтропии (Ds), теплоту (q). Представьте процессы в
T-s- диаграмме.
Теплоемкость принять постоянной согласно молекулярно-кинетической теории газов.
5. При адиабатном сжатии параметры воздуха изменились от p1 = 1 бар, t1 = 10 0С до p2 = 30 бар.
Определите конечную температуру воздуха для случаев:
а) с учетом зависимости теплоемкости от температуры, используя табличные значения p0;
б) без учета зависимости теплоемкости от температуры, приняв ее постоянной, согласно молекулярно-кинетической теории газов.
Решение
1. Из табл. 2 Приложения для воздуха при t1 = 10 0С берется значение p01 =1,1323.
С помощью соотношения (4.55) рассчитывается
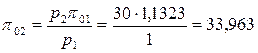 .
.
По значению p02 из таблицы находится t2 = 458,5 0С.
2. Температура воздуха рассчитывается по соотношению (4.48) при
k = 1,4:
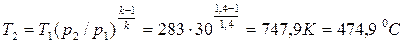 .
.
Ответ: а) t2 = 458,5 0С; б) t2 = 474,9 0С.
Ответы
1. а) Dh= 434 кДж/кг, Du= 313,6 кДж/кг, Ds = 0,4 кДж/(кг×К) ;
б) Dh= 420 кДж/кг, Du= 301,1 кДж/кг, Ds= 0,376 кДж/(кг×К).
2.а) Dh= 306,4 кДж/кг, б) Dh= 305,7 кДж/кг.
4.
| Процессы | n | c, кДж/(кг..К) | D s, кДж/(кг.К) | q, кДж/кг | |||
| Изобарный | 0,55 | ||||||
| Изохорный | µ | 0,72 | 0,396 | 79,2 | |||
| Адиабатный | 1,4 | ||||||
Политропный | 1,2 | -0,72 | -0,396 | -79,2 |
T-s- диаграмма
РЕАЛЬНЫЕ ГАЗЫ И ПАРЫ
Об особенностях реальных газов по сравнению с идеальными, об уравнении состояния и сложности его использования для инженерных расчетов упоминалось в гл. 1.
Настоящая глава посвящена водяному пару, который широко применяется во многих технологических процессах и, прежде всего, в теплоэнергетике, где он является основным рабочим телом.
5.1. Фазовая p-v-T-диаграмма воды и водяного пара
Рассматривается процесс получения пара из воды, залитой в цилиндр (рис. 5.1).
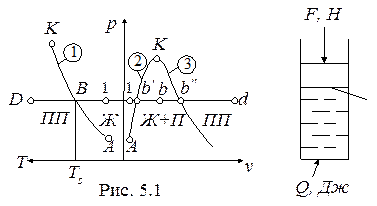
S, м2
Обозначения: 1-линия парообразования; 2- линия кипящей жидкости (нижняя пограничная кривая); 3- линия сухого насыщенного пара (верхняя пограничная кривая); А - тройная точка; К- критическая точка;
Ж– жидкость; П- сухой насыщенный пар; ПП- перегретый пар;
Ts- температура насыщения (температура кипения)
Начальное состояние воды в цилиндре характеризуется давлением p1 = F/S, Н/м2, температурой T1 (точка 1 на диаграммах p-v и p-T ). При подводе тепла Q вода сначала нагревается до температуры кипения (Ts) при p1 = const, затем в процессе кипения при Ts = const и p1 = const преобразуется в пар, который при дальнейшем подводе тепла нагревается до температуры T >Ts.
Обозначения на диаграммах:
1- состояние воды, недогретой до температуры кипения; b¢(B)-кипящая вода (T = Ts, p = p1);
b’' (B) - сухой насыщенный пар (T = Ts, p = p1).
Сухой насыщенный пар имеет температуру, равную температуре насыщения (Ts) при данном давлении.
Мокрый пар - точки b(B) на диаграммах - это смесь кипящей жидкости и сухого насыщенного пара.
Перегретый пар - точки d(D) на диаграммах - имеет температуру выше, чем температура насыщения при данном давлении (T>Ts).
Процесс парообразования (b¢- b¢¢ в p-v- диаграмме) - является изобарно-изотермическим процессом (p1 = const и Ts = const), в котором кипящая вода преобразуется в сухой насыщенный пар (испарение).
Обратный процесс-переход пара в кипящую жидкость называется конденсацией, также является изобарно-изотермическим процессом.
В этих процессах давление и температура взаимосвязаны (Ts = f(p),
ps = f(T)), данная связь на p–T- диаграмме представлена линией парообразования 1,согласно которой с возрастанием давления (p) температура насыщения (Ts) увеличивается.
Таким образом, состояния недогретой до температуры кипения воды и перегретого пара характеризуются двумя независимыми термическими параметрами, например, p и T; состояния кипящей воды, мокрого пара, сухого насыщенного пара - одним термическим параметром p или T.
Тройная точка (состояние А) - это одновременное существование твердой, жидкой и паровой фаз. Параметры тройной точки для воды:
pA = 611 Па, tA = 0,01 0С, vA = 0,001 м3/кг.
Критическая точка (состояние К) - это одновременное существование жидкой и паровой фаз. Для воды параметры критической точки: pkp = 221,15 бар, tkp = 374,12 0С, vkp = 0,003147 м3/кг.
Итак, вода и водяной пар могут находиться в пяти состояниях:
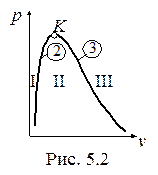 1. Недогретая до температуры кипения вода (область I, рис. 5.2). Параметры обозначаются следующим образом: p, T, v, h, u, s.
1. Недогретая до температуры кипения вода (область I, рис. 5.2). Параметры обозначаются следующим образом: p, T, v, h, u, s.
2. Кипящая вода (нижняя пограничная кривая 2). Параметры обозначаются так: p, Ts, v¢, h¢, u¢, s¢ или так: T, ps, v¢, h¢, u¢, s.¢
3. Мокрый пар (область II). Параметры обозначаются таким образом: p, Ts, v, h, u, s или ps T, v, h, u, s.
4. Сухой насыщенный пар (верхняя пограничная кривая 3). Параметры обозначаются следующим образом: p, Ts, v¢¢, h¢¢, u¢¢, s¢¢ или T, ps, v¢¢, h¢¢, u¢¢, s¢¢.
5. Перегретый пар (область III). Параметры обозначаются так:
p, T, v, h, u, s.
Выше критической точки (К) находится область однофазных состояний, в которой нельзя провести четкой границы между жидкостью и паром.