Молекулярная физика. термодинамика
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ
Высшего профессионального образования
Национальный исследовательский ядерный университет» МИФИ
___________________________________________
Волгодонский инженерно-технический институт
Н.В. Ермолаева, А.Ю. Смолин
Физика
Учебное пособие
к выполнению индивидуальных домашних заданий для студентов очной
формы обучения
Волгодонск, 2011
МОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕРМОДИНАМИКА
Количество вещества системы (в молях) равно
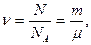
где N – число частиц системы; NA – число Авогадро; m – масса; m – молярная масса.
Если система представляет смесь нескольких газов, то количество вещества системы равно
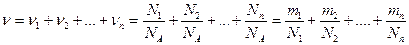 ,
,
где ni , Ni , mi , mi — соответственно количество вещества, число молекул, масса, молярная масса i-й компоненты смеси.
Молярная массавещества равна
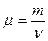 .
.
Молярная масса смесигазов вычисляется по формуле
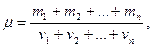
где 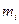 — масса i - го компонента смеси;
— масса i - го компонента смеси; 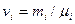 — количество вещества i - го компонента смеси; п — число компонентов смеси.
— количество вещества i - го компонента смеси; п — число компонентов смеси.
Массовая доля wi i - го компонента смеси газа (в долях единицы или в процентах) равна
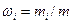 ,
,
где т — масса смеси.
Концентрация молекул (число частиц в единице объема) равна
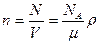 ,
,
где N —число частиц, содержащихся в данной системе; r — плотность вещества; NА – постоянная Авогадро. Формула справедлива для любого агрегатного состояния вещества.
Уравнение Клапейрона—Менделеева (уравнение состояния идеального газа) имеет вид pV = 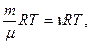
где т – масса газа; m – молярная масса газа; R – универсальная газовая постоянная; n=m/m – количество вещества; Т – термодинамическая температура.
Опытные законы идеального газа, являющиеся частными случаями уравнения Клапейрона—Менделеева для изопроцессов, имеют вид:
а) закон Бойля—Мариотта (изотермический процесс при T=const; m=const; m=const)
pV = const
или для двух состояний газа
P1V1=p2V2,
где p1 и V1 — давление и объем газа в начальном состоянии; p2 и V2 — те же величины в конечном состоянии;
б) закон Гей-Люссака (изобарический процесс при p=const; m=const; m=const)
V/T=const
или для двух состояний
V1/T1=V2/T2,
где V1 и T1— объем и температура газа в начальном состоянии; V2 и Т2 — те же величины в конечном состоянии;
в) закон Шарля (изохорический процесс при V=const; m=const; m=const)
р/T=const
или для двух состояний
p1/T1=p2/T2,
где p1 и T1 — давление и температура газа в начальном состоянии; p2 и T2 — те же величины в конечном состоянии;
г) объединенный газовый закон ( при m=const ; m=const)
pV/T= const
или для двух состояний
p1V1/T1 = p2V2/Т2 ,
где p1, V1 ,T1 — давление, объем и температура газа в начальном состоянии; p2, V2 ,T2– те же величины в конечном состоянии.
Закон Дальтона, определяющий давление смеси газов, имеет вид
р =р1+p2+...+ pi+...+pn,
где pi—парциальные давления компонентов смеси; n – число компонентов смеси.
Основное уравнение кинетической теории газов имеет вид
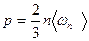 ,
,
где 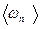 — средняя кинетическая энергия поступательного движения молекулы идеального газа.
— средняя кинетическая энергия поступательного движения молекулы идеального газа.
Средняя кинетическая энергия поступательного движения молекулы равна
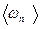 =
= 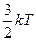 ,
,
где k — постоянная Больцмана.
Средняя полная кинетическая энергия молекулы равна
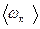 =
= 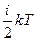 ,
,
где i — число степеней свободы молекулы.
Зависимость давления газа от концентрации молекул и температуры имеет вид
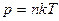 .
.
Распределение Больцмана (распределение молекул газа, находящегося во внешнем силовом поле) имеет вид
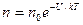 ,
,
где n – концентрация молекул газа; U – потенциальная энергия молекулы; n0 – концентрация молекул в точках поля, где U=0; k – постоянная Больцмана; T – термодинамическая температура; e – основание натурального логарифма.
Распределение Максвелла молекул газа по скоростям теплового движения выражается соотношением
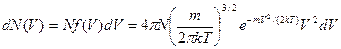 ,
,
где f(V) – функция Максвелла; N – общее число молекул; dN(V) – число молекул, скорости которых лежат в интервале от V до V+dV; m – масса молекулы.
Скорости молекул определяются формулами:
а) средняя квадратичная 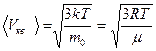 ;
;
б) средняя арифметическая 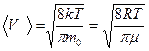 ;
;
в) наиболее вероятная 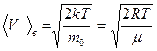 ,
,
где 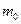 — масса одной молекулы.
— масса одной молекулы.
Удельные теплоемкости газа при постоянном объеме 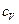 и при постоянном давлении
и при постоянном давлении 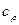 равны:
равны:
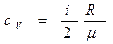 ,
, 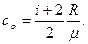
Связь между удельной с и молярной C теплоемкостями имеет вид
 .
.
Уравнение Майера имеет вид
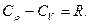
Внутренняя энергия идеального газа равна
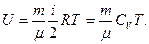
Первое начало термодинамики в общем случае записывается в виде
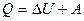 ,
,
где Q— количество теплоты, сообщенное системе; 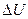 — изменение внутренней энергии системы; А — работа, совершенная системой против внешних сил.
— изменение внутренней энергии системы; А — работа, совершенная системой против внешних сил.
Работа расширения газа равна
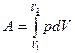 .
.
При изобарическом процессе работа газа равна
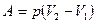 .
.
При изотермическом процессе работа газа определяется формулой
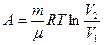
При адиабатическом процессе работа газа равна
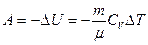 ,
,
или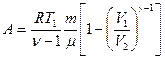 ,
,
где 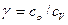 — показатель адиабаты.
— показатель адиабаты.
Уравнения Пуассона, связывающие начальные и конечные параметры идеального газа при адиабатическом процессе, имеют следующий вид:
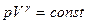 ;
; 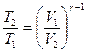 ;
; 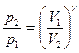 ;
; 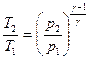 .
.
Термический коэффициент полезного действия цикла определяется формулой
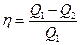 ,
,
где Q1— теплота, полученная рабочим теломот нагревателя;Q2— теплота, переданная рабочим телом охладителю.
Термический коэффициент полезного действия цикла Карно равен
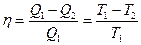 ,
,
где T 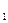 и T
и T 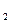 — термодинамические температурынагревателя иохладителя соответственно.
— термодинамические температурынагревателя иохладителя соответственно.
Энтропия термодинамической системы может быть вычислена по формуле Больцмана:
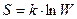 ,
,
где S – энтропия; W – термодинамическая вероятность состояния системы; k – постоянная Больцмана.
Изменение энтропии равно:
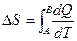 ,
,
где А и В – пределы интегрирования, соответствующие начальному и конечному состояниям системы.
Уравнение состояния реального газа (уравнение Ван-дер-Ваальса) имеет вид
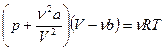 ,
,
где a и b – постоянные Ван-дер-Ваальса.
Коэффициент поверхностного натяжения жидкости равен
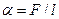 или
или 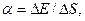
где F — сила поверхностного натяжения, действующая на контур, ограничивающий поверхность жидкости; 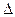 E —изменение свободной поверхностной энергии пленки жидкости, связанное с изменением площади
E —изменение свободной поверхностной энергии пленки жидкости, связанное с изменением площади 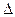 S поверхности этой пленки.
S поверхности этой пленки.
Формула Лапласа, выражающая давление p , создаваемое сферической поверхностью жидкости, имеет вид
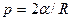 ,
,
где R — радиус сферической поверхности.
Высота подъема жидкости в капиллярной трубке определяется формулой
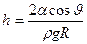 ,
,
где 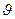 — краевой угол (
— краевой угол ( 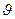 = 0 при полном смачивании стенок трубки жидкостью;
= 0 при полном смачивании стенок трубки жидкостью; 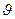 = p при полном несмачивании); R—радиус канала трубки;
= p при полном несмачивании); R—радиус канала трубки; 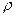 — плотность жидкости; g — ускорение свободного падения.
— плотность жидкости; g — ускорение свободного падения.
Высота подъема жидкости между двумя близкими и параллельными друг другу плоскостями равна
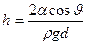 ,
,
где d — расстояние между плоскостями.
Примеры решения задач
1. Кислород массой 320 г. нагревают при постоянном давлении от 300 до 310К. Определить количество теплоты, поглощенное газом, изменение внутренней энергии и работу расширения газа.
| Дано: | 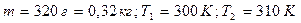 |
| Найти: | 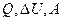 |
Решение: Количество теплоты, необходимое для нагревания газа при постоянном давлении, определим из 1- го начала термодинамики:
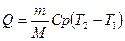 (1)
(1)
Здесь Ср - молярная изобарная теплоемкость, M – молярная масса газа;
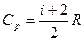 , где
, где 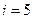 для кислорода как двухатомного газа;
для кислорода как двухатомного газа;
M=32 кг/кмоль = 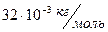
Подставляя в (1) числовые значения, получим:
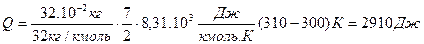
Изменение внутренней энергии газа:
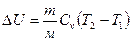 (2)
(2)
Подставляя числовые значения и учтя, что 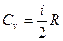 , получим:
, получим:
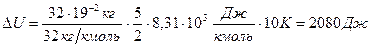
Работа расширения газа при изобарном процессе: 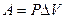 , (3), где
, (3), где 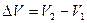 - изменение объема газа при расширении можно найти из уравнения Клапейрона-Менделеева:
- изменение объема газа при расширении можно найти из уравнения Клапейрона-Менделеева:
Для двух состояний газа при изобарном процессе: 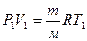 (4)
(4)
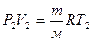 (5),
(5),
и тогда вычитая почленно (5) из (4), получим:
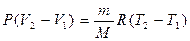
и подставляя в (3), находим:
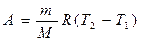 =
= 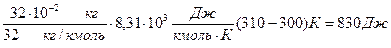
Проверка: Q = ∆U + A; 2910 Дж = 2080 Дж + 830 Дж.
Ответ: Q= 2910 Дж, U=2080 Дж, A=830Дж.
2. Как изменится энтропия 2 г водорода, занимающего объем 40 л при температуре 270К, если давление увеличить вдвое при постоянной температуре, а затем повысить температуру до 320К при постоянном объеме.
Дано: m = 2 г = 2∙10-3 кг; М = 2 кг/моль; V = 40 л = 4∙10-2 м3 Т1 = 270К; Т2 = 320К; Р2= 2Р1.
Найти: ΔS.
Решение: Изменение энтропии определяется формулой: 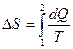 ,
,
где dQ – количество теплоты, полученное в данном процессе.
Изменение энтропии согласно условию происходит за счет двух процессов:
1) изотермического и 2) изохорического. Тогда:
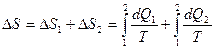
Количество теплоты dQ1 и dQ2 найдем из 1- го начала термодинамики для этих процессов:
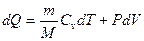 .
.
1) 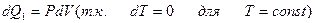
P найдем из уравнения Клапейрона-Менделеева:
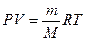 , тогда
, тогда 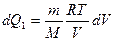 и
и
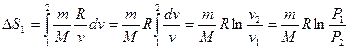 ;
;
т.к. при T = const, P1V1 = P2V2 .
2) 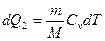 (т.к. dV = 0 и dA = 0 при V = const)
(т.к. dV = 0 и dA = 0 при V = const)
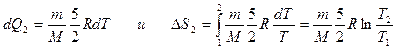 ;
; 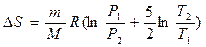
Подставляя численные значения, получим:
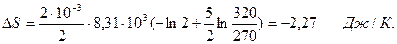
Ответ: DS= -2,27Дж/К.
