ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. Методические указания, контрольные задания по курсу общей химии для студентов нехимических специальностей заочной формы обучения
ХИМИЯ
Методические указания, контрольные задания по курсу общей химии для студентов нехимических специальностей заочной формы обучения
Часть 2
Нижний Новгород 2013
Составители: А.Д. Самсонова, О.Н. Ковалева, Т.В Сазонтьева, Г.А. Паничева
УДК 54 (07)
Химия: методические указания, контрольные задания по курсу общей химии для студентов нехимических специальностей заочной формы обучения/ НГТУ им. Р.Е. Алексеева сост.: А.Д. Самсонова, О.Н. Ковалева, Т.В Сазонтьева, Г.А. Паничева Н.Новгород, 2013. 54 с.
Предложены теоретическая часть, примеры решения типовых задач и задания по темам: «Окислительно-восстановительные реакции», «Электрохимические процессы», «Коррозия»
Научный редактор Наумов В.И.
Редактор Э. Б. Абросимова
Подп. к печ.11.04. 2013 Формат 60х84 1/16. Бумага газетная.
Печать офсетная. Печ. л. 3,375. Уч.-изд. л. 2,6.
Тираж 1500 экз. Заказ

Нижегородский государственный технический
университет им. Р.Е. Алексеева
Типография НГТУ. 603950, Н.Новгород, ул. Минина, 24.
© Нижегородский государственный технический университет, им. Р.Е. Алексеева, 2013
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Оксилительно-восстановительные реакции (ОВР) – это такие реакции, в которых происходит передача электронов от одних частиц (атомов, молекул, ионов) к другим, в результате чего степень окисления атомов, входящих в состав этих частиц, изменяется.
СТЕПЕНЬ ОКИСЛЕНИЯ
Степень окисления элемента – это условный заряд его атома в молекуле, если считать, что молекула состоит из ионов. Она может быть положительной, отрицательной и нулевой.
Для нахождения степеней окисления используют следующие правила:
1. Степени окисления элементов в простых веществах равны «0» (например, 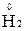 ,
, 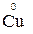 ,
, 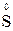 ,
, 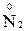 );
);
2. Степень окисления щелочных металлов всегда равна «+1», а щелочноземельных «+2» (например, 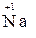 ,
, 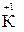 ,,
,, 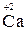 );
);
3. Степень окисления фтора равна «-1» ( 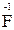 );
);
4. Водород проявляет во всех соединениях степень окисления «+1», за исключением гидридов щелочных и щелочноземельных металлов, в которых степень окисления водорода равна «–1» (например, ( 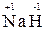 ,
, 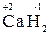 );
);
5. Степень окисления кислорода в соединениях равна –2, кроме пероксидов, в которых степень окисления равна «-1» (например, 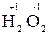 ,
, 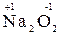 ).
).
6. Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле равна нулю, а в ионе – заряду иона.
Пример 1. Определить степень окисления серы в молекуле H2SO4.
Решение. Атом водорода имеет степень окисления +1, а атом кислорода -2.
Для определения степени окисления серы в молекуле 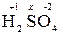 составляем уравнение 2 (+1) + x + 4(-2) = 0, откуда х = +6.
составляем уравнение 2 (+1) + x + 4(-2) = 0, откуда х = +6.
Именно это число и является степенью окисления серы 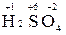 .
.
Окислительно-восстановительная реакция – это единый процесс, состоящий из двух полуреакций: полуреакции окисления и полуреакции восстановления, которые идут одновременно.
Окисление – это процесс отдачи электронов атомом, молекулой или ионом.
Восстановление – это процесс присоединения электронов атомом, молекулой или ионом.
Частица, отдающая свои электроны, в ходе реакции окислятся. Ее принято называть ВОССТАНОВИТЕЛЕМ (обозначим ее как ВОС):
ВОС - nē → продукт окисления (окисленная форма).
Частица, которая эти электроны присоединяет, в ходе реакции восстанавливается. Ее принято называть ОКИСЛИТЕЛЕМ (обозначим ее как ОК):
ОК + nē → продукт восстановления (восстановленная форма).
Например, в реакции 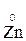 +
+ 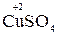 →
→ 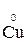 +
+ 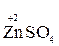
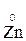 - 2 ē →
- 2 ē → 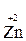 (полуреакция окисления)
(полуреакция окисления)
Восстановитель окисленная форма
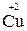 + 2ē
+ 2ē  →
→ 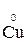 (полуреакция восстановления)
(полуреакция восстановления)
Окислитель восстановленная форма
Соединения, имеющие в своем составе атомы, в высшей положительной степени окисления могут проявлять только окислительные свойства. Соединения, имеющие в своем составе атомы, в низшей отрицательной степени окисления могут проявлять только восстановительные свойства. Соединения, имеющие в своем составе атомы, в промежуточной степени окисления могут проявлять как окислительные, так и восстановительные свойства.
Например, азот может иметь следующие степени окисления: -3, -2, -1, +3, +5. В соединении KNO2 азот имеет промежуточную степень окисления +3, следовательно, нитрит-ион NO2- может проявлять как окислительные, так и восстановительные свойства. С достаточно сильным восстановителем он может реагировать как окислитель:
2 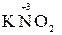 + 2
+ 2 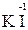 + 4 HCl→
+ 4 HCl→ 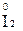 + 2
+ 2 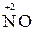 + 4KCl + 2H2O,
+ 4KCl + 2H2O,
а с достаточно сильным окислителем – как восстановитель:
5 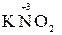 +2
+2 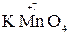 + 3H2SO4 → 2
+ 3H2SO4 → 2 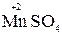 + 5
+ 5 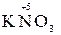 + K2SO4 + 3H2O
+ K2SO4 + 3H2O
СОСТАВЛЕНИЕ УРАВНЕНИЙ
