Пример 3. Реакция выражается схемами:
Реакция выражается схемами:
1. KClO3  KClO4 + KCl.
KClO4 + KCl.
2. (NH4)2S + K2Cr2O7 + H2O  S + Cr(OH)3 + NH3 + KOH.
S + Cr(OH)3 + NH3 + KOH.
Составьте электронные уравнения, расставьте коэффициенты, укажите окислитель и восстановитель.
Решение.
Для подбора коэффициентов уравнения воспользуемся методом электронного баланса.
1. Записываем уравнение реакции и находим атомы, меняющие степень окисления:
K 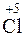 O3 ® K
O3 ® K  O4 + K
O4 + K  .
.
2. Составляем электронные уравнения и находим окислитель и восстано-витель:
Cl+5 – 2 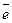 = Cl+7, Cl+5 – восстановитель,
= Cl+7, Cl+5 – восстановитель,
Cl+5 + 6 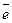 = Cl–1, Cl+5 – окислитель.
= Cl–1, Cl+5 – окислитель.
В этом уравнении Cl+5(KClO3) является одновременно и окислителем, и восстановителем. Такая окислительно-восстановительная реакция называется реакцией диспропорционирования (самоокисления-самовосстановления).
3. Находим коэффициенты для окислителя, восстановителя и продуктов их превращения. Число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. Для этого находим наименьшее общее кратное и множители:

 Cl+5 – 2
Cl+5 – 2 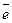 = Cl+7 3 (1)
= Cl+7 3 (1)
Cl+5 + 6 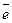 = Cl– 1 (2)
= Cl– 1 (2)
Ставим эти множители в уравнение (1). Перед KClO3 ( 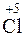 ) ставится суммарный множитель (3 + 1 = 4). Коэффициенты у формул остальных веществ подбираются как обычно, путем сопоставления числа атомов в правой и левой частях уравнения:
) ставится суммарный множитель (3 + 1 = 4). Коэффициенты у формул остальных веществ подбираются как обычно, путем сопоставления числа атомов в правой и левой частях уравнения:
4KClO3 = 3KClO4 + KCl.
По той же методике расставим коэффициенты во втором уравнении:
3(NH4)2S–2 + K2Cr2+6O7 + H2O = 3S0 + 2Cr+3(OH)3 + 2KOH + 6NH3
 |  |
S–2 – 2 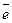 = S0 3
= S0 3
Cr+6 + 6 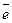 = 2Cr+3 1
= 2Cr+3 1
