Изучение процессов коагуляции
ЛАБОРАТОРНАЯ РАБОТА № 2
- Цель работы
Изучение влияния коагулянтов и рН-среды на эффективность осветления воды при отстаивании.
- Теоретические сведения
Коагуляция используется для очистки природных и промышленных сточных вод в основном от загрязняющих веществ, которые находятся в коллоидном взвешенном состоянии. Суть её заключается в том, что в воду добавляют вещества – коагулянты. Чаще всего – это соли алюминия и железа, а также их смеси, но можно использовать и соли других многовалентных катионов – магния, титана. Коагулянты – это соли сильных кислот и слабых щелочей. Они гидролизуются с образованием солей гидрооксидов, которые имеют развитую поверхность и которые сорбируют на ней различные примеси. При этом частички увеличиваются (коагулируют) и осаждаются вместе с коллоидными и взвешенными вещества.
Гидролиз сульфата алюминия, гидроксохлорида алюминия и хлорида железа можно представить в виде суммарных реакций:
Al2(SO4)3 + 6HOH ↔ 2Al(OH)3 + 3H2SO4 Al3+ : H+ = 1:3 (1)
2Al3+ + 6HOH ↔ 2Al(OH)3 + 6H+
Al2(OH)5Cl + HOH ↔ 2Al(OH)3 + HCl Al3+ : H+ = 1:0.5 (2)
[Al2(OH)5]+ + HOH ↔ 2Al(OH)3 + H+
FeCl3 + 3HOH ↔ Fe(OH)3 + 3HCl Fe3+ : H+ = 1:3 (3)
Fe3+ + 3HOH ↔ Fe(OH)3 + 3H+
В уравнении (2) приведена реакция гидролиза высокоосновного гидроксохлорида алюминия, который как коагулянт имеет ряд преимуществ перед сульфатом алюминия. Одним из них является то, что он имеет высокую коагулирующую способность в более широком интервале рН, так как при одинаковой дозе коагулянта выделяется меньшее количество протонов. Гидроксохлорид алюминия обеспечивает образование больших хлопьев, которые быстро осаждаются. Благодаря содержанию в своём составе хлорид-ионов, гидроксохлорид алюминия при гидролизе образует стойкие коагуляционные структуры, которые не разрушаются при перемешивании. Кроме того, хлориды снижают водоудерживающую способность частиц золя гидрооксида, что способствует коагуляции. Расход гидроксохлорида алюминия на 25...30% ниже при одинаковом эффекте очистки по сравнению с сульфатом алюминия. Следует отметить, что использование сульфата алюминия при высокой жесткости воды приводит к отложению сульфатов кальция и магния. Сульфат ионы связываются с катионами алюминия в стойкие комплексы, при этом происходит большой расход коагулянта.
В связи с вышеперечисленным следует, что гидроксохлорид алюминия более перспективный реагент для очистки воды, чем традиционный коагулянт – сульфат алюминия. При сравнении сульфата алюминия и хлорида железа как коагулянта следует отметить, что при низких температурах первый практически не коагулирует, тогда как коагулирующая способность хлорида железа практически не зависит от температуры воды. Недостатком хлорида железа является способность катионов железа образовывать окрашенные комплексы с некоторыми органическими лигандами, которые присутствуют в воде. При этом окраска воды увеличивается. Использование смешенных коагулянтов позволяет избавиться от недостатков, которые имеют отдельные соединения и приобрести ряд ценных качеств. Оптимальное соотношение: FeCl3 : Al2(SO4)3 = 1:1.
Реже используются соли железа (II). Недостатком является то, что одновременно с ними необходимо водить в воду окислители, чаще всего хлор, который переводит железо (II) в железо (III).
Процесс коагуляции и очистка воды зависят от следующих факторов: природы и дозы коагулянта, состава и рН воды, температуры, ионного состава воды. При оптимальной дозе коагулянта достигается максимальное удаление из воды загрязняющих веществ и практически полное отсутствие остаточного количества алюминия и железа в воде. Существуют несколько определений оптимальной дозы коагулянта. По ГОСТу 2874-82 оптимальной дозой До называется минимальная доза, которая обеспечивает прозрачность очищенной воды 30 см «по шрифту».
Как видно из уравнений 1-3 в процессе гидролиза образуются ионы водорода Н+ (ионы гидроксония Н3О+ или протоны) и среда подкисливается. Для того, чтобы обеспечить полный гидролиз коагулянта, необходимо нарушить равновесие справа веществами, которые имеют щелочной характер NaOH, Na2CO3, Ca(OH)2 или ионами CO32- и НСО3-, которые в природных водах выполняют роль буферной системы, что даёт возможность поддерживать в воде определённый интервал рН. При этом протоны связываются в малодиссоциированную воду или малостойкие соединения угольной кислоты.
Н+ + ОН- = Н2О (4)
Н+ + НСО3- = Н2СО3 = Н2О + СО2 (5)
Представим гидролиз щелочных коагулянтов в природной воде следующими уравнениями:
Al2(SO4)3 + 3Ca(HCO3)2 = 2Al(OH)3 + CaSO4 + CO2 (6)
342 6 мг-экв HCO3-
1 мг 0.0052
2Al2(OH)5Cl + Ca(HCO3)2 = 4Al(OH)3 + CaCl2 + CO2 (7)
349 2 мг-экв HCO3-
1 мг 0.0057
FeCl3 + 3Ca(HCO3)2 = Fe(OH)3 + CaCl2 + CO2 (8)
324.8 6 мг-экв HCO3-
1 мг 0.018
Таким образом, при гидролизе 1 мл сульфата алюминия, гидроксохлорида алюминия, хлорида железа на связывание Н+ используются 0.0052, 0.0057, 0.018 мг-экв ионов НСО3- или мг-экв щелочности. Поэтому для практических целей, при очистке природных вод щелочность воды определяется по формулам:
Сульфат алюминия: Щ = 0.0052∙Д+1 (9)
Гидроксохлорид алюминия: Щ = 0.0057∙Д+1 (10)
Хлорид железа: Щ = 0.018∙Д+1 (11)
где Д – доза коагулянта, мг/л;
Щ – щелочность воды, мг-экв/л;
1 – резервная щелочность, мг-экв/л.
При недостаточной щелочности природной воды и её высокой каломутности невозможно подобрать оптимальную дозу коагулянта. Поэтому для повышения щелочности воды проводят её подщелачивание. Можно использовать различные щелочные реагенты, чаще всего - это суспензия извести благодаря её широкой распространённости и низкой стоимости. При использовании сульфата алюминия известь имеет преимущества ещё и в том, что ионы кальция образуют малорастворимый сульфат. В данном случае солесодержание и жесткость воды не увеличиваются:
H+ + SO42- + Са2++2OH- = CaSO4 + 2H2O (12)
При коагуляционной очистке воды соединениями алюминия (соли, гидроксохлорид, алюминат) следует уделять особое внимание рН среды, так как Al(OH)3 имеет амфотерный характер, и в кислой среде растворяется с образованием Al3+, в щелочной среде – алюминат-иона. И в том и другом случае происходит не полный гидролиз коагулянта и остаётся высокое содержание алюминия в очищенной воде.
Изоэлектрическая точка коагуляции х.ч. Al(OH)3 в дистиллированной воде соответствует рН≈5.5 (при этом растворимость минимальная и составляет ≈0.3 мг/дм3). рН изоэлектрической точки повышается в природной воде и большей степени зависит от анионного состава, чем от катионного. Так в природных водах коагуляция коллоида Al(OH)3, который образуется в результате гидролиза Al2(SO4)3, происходит довольно хорошо при рН 5.7 – 7.8; в мягких водах при рН 5.7 – 6.6; в водах средней жесткости (12-170С) – при рН 6.6 – 7.2; в водах высокой жесткости – при рН 7.3 – 7.8. Поэтому перед проведением коагуляции необходимо знать состав воды для корреляции щелочности.
Процесс гидролиза многозарядных катионов алюминия и железа является обратной реакцией, для которой используется эмпирическое правило Вант-Гоффа: повышение температуры на каждые 100С увеличивает её скорость приблизительно 2-4 раза:
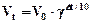 , (13)
, (13)
где γ – температурный коэффициент скорости реакции.
При повышении температуры снижается степень гидратации золя Al(OH)3, его стойкость и растворимость, что увеличивает скорость образования и осаждения хлопьев, улучшает качество очистки.
Снижение температуры приводит к замедлению коагуляции вследствие снижения кинетического движения частиц и числа активных столкновений, а также увеличения вязкости воды. Последнее связано с рН уравнением:
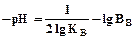 (14)
(14)
где Кв – ионное произведение воды, 1∙10-14;
Вв – плотность воды.
Поэтому при низких температурах повышается вязкость и увеличивается расход щелочного реагента в связи с ростом оптимального рН коагуляции. Так, снижение температуры от 50 до 0 0С повышает рН от 6.63 до 7.47. Оптимальной температурой для коагуляции, при использование сульфата алюминия является 25…30 0С; при снижении температуры дозу коагулянта увеличивают.
Иногда для определения оптимальной дозы коагулянта используют эмпирическую формулу, в которой учитывают несколько параметров воды: цветность (Ц), щелочность (Щ), температуру (Т) и остаточное содержание хлора после хлорирования [Cl]:
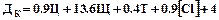 (15)
(15)
- Оборудование, приборы, материалы, реактивы
Оборудования:
- цилиндр для определения прозрачности воды;
- мерные цилиндры емкостью 50, 100, 250 см3;
- колбы конические емкостью 250 см3;
- пипетки емкостью 1, 2, 5, 10 см3;
- мерные колбы емкостью 50 см3;
- текст с шифром № 1 с высотой буквы 3.5 мм.
Приборы:
- рН-метр;
- установка для титрования;
- секундомер.
Реактивы:
- модельная природная вода;
- раствор хлорида железа 25 г/дм3;
- раствор роданида калия или аммония 50%-й;
- персульфат аммония;
- стандартный раствор железа, 0.1 г/дм3 по Fe3+ (0.8636 г NH4Fe(SO4)2∙12H2O растворить в 1 дм3 дистиллированной воды);
- раствор соляной кислоты, 0.05 н;
- раствор индикатора: метилового оранжевого;
- раствор гидроокиси кальция, 1 г/дм3.
