Тема. Газовые законы. Изопроцессы. Всякая система может находиться в различных состояниях, отличающихся температурой, давлением, объёмом и т.д
Всякая система может находиться в различных состояниях, отличающихся температурой, давлением, объёмом и т.д.
Величины p, V, T и др. характеризующие состояние системы, называются параметрами состояния.
Если какой-либо из параметров меняется внутри системы от точки к точке, то такое состояние называется неравновесным. Если параметры системы во всех точках одинаковы при неизменных внешних условиях, то такое состояние называется равновесным.
Всякий процесс, т.е. переход системы из одного состояния в другое связанно с нарушением равновесия системы. Однако бесконечно медленный процесс будет состоять из последовательности равновесных состояний. Такой процесс называется равновесным. При достаточно медленном протекании реальные процессы могут приближаться к равновесному. Равновесный процесс является обратимым, т.е. система переходит из состояния 1 в состояние 2 и обратно 2 - 1, проходя через одни и те же промежуточные состояния. 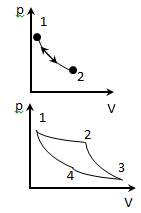
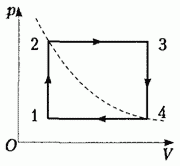
· Процесс, при котором система, пройдя ряд промежуточных состояний, возвращается в исходное состояние, называется круговым процессом или циклом: процесс 1-2-3-4-1 на рисунке.
· Связь между параметрами состояния называется уравнением состояния: f(p,V,T)=0
· Клапейрон, используя законы Бойля-Мариотта и Шарля вывел уравнение состояния идеального газа.
1 – 1’: T = const – закон Бойля – Мариотта: p1V1 = p1’ V2; 
· 1’ – 2: V = const – закон Шарля:
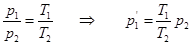
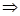
 т.к. состояния 1и 2 выбраны произвольно, то для данной массы газа величина
т.к. состояния 1и 2 выбраны произвольно, то для данной массы газа величина  остается постоянной
остается постоянной
· 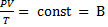 – уравнение Клапейрона
– уравнение Клапейрона
· В- газовая постоянная, различая для различных газов.
· Менделеев объединил уравнение Клапейрона с законом Авогадро
( 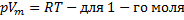 ) Vm- молярный объём
) Vm- молярный объём
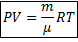
· Уравнение Менделеева-Клапейрона
· R- универсальная (молярная) газовая постоянная.
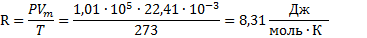


· p = const;  ;
;
· 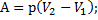
· 
· Физический смысл R: численно равна работе, совершаемой газом при изобарическом (p = const) нагревании одного моля газа ( 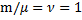 ) на один Кельвин (?Т=1 К)
) на один Кельвин (?Т=1 К)
· Введем постоянную Больцмана 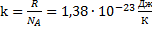
тогда
· 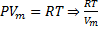 =
= 
· 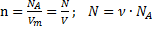

· p = n k T
· p - давление идеального газа при данной температуре прямо пропорционально концентрации его молекул (или плотности газа). При одинаковых p и T все газы содержат в единице объёма одинаковое число молекул.
· n - концентрация молекул (число молекул в единице объёма ). Число молекул, содержащихся при нормальных условиях в 1 м3 называется числом Лошмидта
· 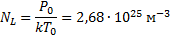
Примеры решения задач:
Задача 1. Вычислить молекулярную массу бензола, зная, что масса 600 мл его паров при 87°C и давлении 83,2 кПа равна 1,30 г.
Решение 1. Выразив данные задачи в единицах СИ и подставив их в уравнение Клапейрона-Менделеева, находим: М = 0,0013*8,31*360/(83200*0,0006) = 0,078 кг/моль = 78 г/моль.
Задача 2. В баллоне объемом V= 10 л находится гелий под давле нием 1=l МПа при температуре T1=300 К. После того как из баллона был израсходован гелий массой m=10 г,температура в баллоне понизилась до T2=290 К. Определить давление 2 гелия, оставшегося в баллоне.
Решение 2. Для решения задачи воспользуемся уравнением Клапейрона — Менделеева, применив его дважды к начальному и конечному состояниям газа. Для начального состояния уравнение имеет вид
p1V(m1/M)RT1, (1) а для конечного состояния —
p2V(m2/M)RT2, (2) где m1 и m2 — массы гелия в начальном и конечном состояниях.
Выразим массы m1 и m2 гелия из уравнений (1) и (2):
m1=Mp1V/(RT1); (3)
m2=Mp2V/(RT2); (4)
Вычитая из (3) равенство (4), получим
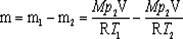 .
.
Отсюда найдем искомое давление:
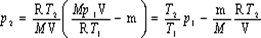 .
.
Проверим, дает ли правая часть формулы (5) единицу давления. Для этого выразим все величины, входящие в нее, в соответствующих единицах. Единица, в которой выражается первое слагаемое, не вызывает сомнений, так как отношение T2/T1 — величина безразмерная. Проверим, в каких единицах выражается второе слагаемое:
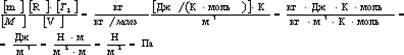
Убедившись в том, что правая часть полученной расчетной формулы дает единицу искомой величины—давления, можем подставить в (5) значения всех величин и произвести вычисления.
В формуле (5) все величины, кроме молярной массы М гелия, известны. Найдем ее (см. пример 1). Для гелия как одноатомного газа относительная молекулярная масса равна его относительной атомной массе Аr.
Из таблицы Д. И. Менделеева найдем Аr=4. Следовательно, молярная масса гелия М= Аr10-3 кг/моль =410-3 кг/моль. Подставив значения величин в (5), получим
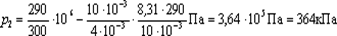 .
.
Домашнее задание:
1. Учить лекционный материал.
2. Решить задачи:
1. Плотность некоторого газообразного вещества равна 1,5 кг/м3 при 12° C и нормальном атмосферном давлении. Определить молярную массу этого вещества.
2.С идеальным газом, количество вещества которого n = 0,500 моль, совершают замкнутый циклический процесс. Точки 2 и 4 этого процесса находятся на одной изотерме, участки 1 → 2 и 3 → 4являются изохорами, а участки 2 → 3 и 4 → 1 — изобарами. Начертите этот процесс в координатах температуры и объема.
 |
3. Чему равна средняя квадратичная скорость движения молекул идеального газа, если имея массу 6 кг, он занимает объем 5 кубических метров при давлении 200 кПа?
4. В сосуде емкостью 10 л при нормальных условиях находится азот. Определить: число молей азота, массу азота и концентрацию молекул в сосуде.
