Пример 2. Почему хлор способен к реакциям самоокисления-самовосстановления (диспропорционирования)?
Почему хлор способен к реакциям самоокисления-самовосстановления (диспропорционирования)? На основании электронных уравнений напишите реакцию растворения хлора в едком натре.
Решение.
Степень окисления хлора в молекуле равна нулю, т. е. имеет промежуточное значение между (–1) и (+1, +3, +5, +7) в соединениях. Поэтому один атом хлора в молекуле присоединяет к себе электрон от другого атома, другой отдает. В результате один атом хлора окисляется (степень окисления повышается), а другой восстанавливается (степень окисления понижается). Распишем электронные уравнения и на их основе уравнения реакций.
Электронные уравнения:
Cl 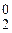 – 2
– 2 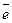 = 2Cl+1 – окисление ,
= 2Cl+1 – окисление ,
Cl 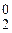 + 2
+ 2 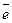 = 2Cl–1 – восстановление.
= 2Cl–1 – восстановление.
Уравнения реакции растворения хлора в щелочи:
2NaOH + Cl2 = NaClO + NaCl + H2O.
