Внутренняя энергия газа
Увеличение температуры газа приводит к увеличению ее внутренней энергии. Под внутренней энергией подразумевается сумма его внутренней кинетической энергии молекул и внутренней потенциальной энергии молекул. Внутренняя энергия газа обозначается в термодинамике буквой “u” для единицы веса (1 кг) газа и через “U” для произвольного количества газа и измеряется в тепловых единицах “u” в ккал/кг, “U” в ккал.
Внутренняя энергия реального газа определяется значениями двух термодинамических параметров при использовании уравнения состояния внутреннюю энергию газа можно представить как функцию, зависящую от 2-х параметров из 3-х. u = f1 (T, w), u = f2 (T, p), u = f3 (p, w).
Отсюда следует, что изменение внутренней энергии газа не зависит от характера процесса перехода его от одного состояния к другому и определяется начальным и конечным состоянием газа, т.е. является однозначной функцией его состояния. На рис. 4 представлены различные процессы перехода газа из начального состояния (точка 1) в конечное состояние (точка 2). Процессы обозначены кривыми “a”, “в” и “c”.
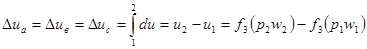
Идеальный газ не обладает силами взаимодействия молекул. Его внутренняя энергия состоит лишь из кинетической энергии молекул.
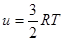
Таким образом, для идеального газа его внутренняя энергия является только функцией температуры u = f (T). Пороховой газ при выстреле из баллистического орудия для расчета внутренней энергии рассматривается
 Р
Р
 1
1



 Р1 a
Р1 a
в
с

 Р2 2
Р2 2
 |
w1 w2 w
Рис. 4
как идеальный, например, для изохорного процесса (w = const). Тепло, подведенное к газу q = Сw (t2º - t1º). Т.к. газ в этом процессе не совершает работу, все подведенное тепло идет на увеличение его внутренней энергии, т.е. Δu = q Δu = Сw (t2º - t1º) и ΔU = ω·Сw (t2º - t1º) = u2 – u1
