Требования к выполнению контрольных заданий
НИЖЕГОРОДСКИЙ ИНСТИТУТ ТЕХНОЛОГИЙ И УПРАВЛЕНИЯ (ФИЛИАЛ)
ФГБОУ ВПО МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ТЕХНОЛОГИЙ И УПРАВЛЕНИЯ ИМЕНИ К.Г.РАЗУМОВСКОГО
Кафедра технических и естественнонаучных дисциплин
Аналитическая химия
Качественный и количественный химический анализ
Контрольные задания для студентов-заочников I курса по направлениям:
260100, 260800
Нижний Новгород – 2011
Общие методические указания
Требования к выполнению контрольных заданий
Задания для контрольных работ содержит 20 вариантов. Студент выполняет контрольные работы в соответствии с двумя последними цифрами своего учебного шифра в зачетной книжке. Если в номере две последние цифры больше 20, то из них вычитают ближайшее меньшее число, кратное 20. например: при учебном шифре оканчивающемся на 57 надо выполнить вариант 17 т.к. (57-20*2)=17, а если шифр оканчивается на 00- вариант 20.
| № вар. | Номера заданий | |||||||||
Таблица
Кислотно-основной метод анализа катионов
Аналитические группы
| I Ag+,Pb2+, Hg22+ | II Ba2+, Sr2+, Ca2+, (Pb2+) | III Al3+,Cr3+,Zn2+, Sn2+,Sn4+,As5+, As3+,(Sb3+) | IV Mg2+, Mn2+, Fe2+, Fe3+, Bi3+, Sb3+, Sb5+ | V Cu2+,Cd2+, Ni2+,Co2+ | VI K+,Na+, NH4+ | |
| Характери-стика групп | Хлориды нерастворимые в воде и в кислотах | Сульфаты нерастворимые в воде и кислотах | Гидроксиды растворимые в избытке щелочи | Гидроксиды нерастворимые в избытке щелочи | Гидроксиды растворимые в аммиаке | Хлориды, сулфаты и гидроксиды растворимые в воде |
| Групповой реагент | 2 N раствор HCl | 2 N раствор H2SO4 | Избыток 4 N раствора NaOH или КОН | Избыток 4 N раствора щелочи | Избыток 25% раствора аммиака | Не имеет |
| Характер полу- чаемых соеди- нений | Осадок AgCl, PbCl2,Hg2Cl2 | BaSO4,SrSO4, CaSO4,(PbSO4) | Раствор AlO2-CrO2-, ZnO22-,SnO32-, AsO33-,(SbO33-) | Осадок Mg(OH)2, Mn(OH)2, Fe(OH)2, Fe(OH)3, HSbO3,Bi(OH)3, HSbO2 | Раствор [Cu(NH3)4]2+, [Hg(NH3)4]2+, [Cd(NH3)4]2+, [Ni(NH3)6]2+, [Co(NH3)6]2+ | Раствор K+,Na+, NH4+ |
КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. В чем заключается сущность систематического хода анализа? Какие реактивы называют групповыми? Как, пользуясь кислотно-основным методом, разделить катионы Ag+и Pb2+?
2. В чем заключается сущность дробного метода анализа? Приведите пример специфической реакции обнаружения катиона.
3. Как и для чего проверяют полноту осаждения отделяемого катиона? К каким ошибкам кислотно-основного метода приведет неполное осаждение катионов II группы для последующего обнаружения катионов III группы в ходе анализа их смеси? Уравнения реакций напишите в вещественной и ионной формах.
4. К каким ошибкам приводит в кислотно-основном методе неполное осаждение катиона Ba2+ для последующего обнаружения катиона Са2+? Напишите уравнения реакций обнаружения этих катионов в вещественной и ионной формах.
5. Приведите в вещественной и ионной формах уравнения реакций хлорида бария с дихроматом калия. Как можно сдвинуть равновесие в реакции Cr2O72-+H2O=2CrO42-+2H+ в ту или другую сторону? С какой целью прибавляют ацетат натрия?
6. Почему гидроксид магния не осаждается в присутствии солей аммония? Напишите реакцию взаимодействия хлорида магния с гидрофосфатом натрия в вещественной и ионной формах.
7. Что называется степенью диссоциации (ионизации)? Как изменяется степень диссоциации слабых электролитов при добавлении одноименных ионов и при разбавлении растворов?
8. Чем различается диссоциация (ионизация) в водных растворах сильных и слабых электролитов? Приведите примеры схем ионизации. Что такое активность?
9. В чем заключается сущность протолитической теории Бренстеда-Лоури? Приведите примеры кислот, оснований.
10. Какие соединения являются в водном растворе кислотами, а какие основаниями с точки зрения протолитической теории Бренстеда-Лоури: Н2О, NH3, HClO4, CN-, CO32-, HCO3-, Cl-?
11. Что такое сила кислот и оснований в соответствии с протолитической теорией? Приведите примеры.
12. Что такое активность, коэффициент активности, ионная сила раствора? В каких случаях коэффициент активности можно принять равным единице?
13. Какие вещества называют электролитами и неэлектролитами? Сильные и слабые электролиты. Приведите примеры.
14. Какие электролиты называют сильными и слабыми? Что называют степенью диссоциации (ионизации)? Каково ее математическое выражение? Напишите формулы известных Вам сильных и слабых кислот и оснований. Найдите в справочнике значения констант диссоциации (ионизации).
15. Напишите математическое выражение константы диссоциации (диссоциации) уксусной кислоты. Найдите ее числовое значение в справочнике. Имеют ли сильные электролиты константы диссоциации?
16. Сформулируйте закон действующих масс. Что называют константой химического равновесия? Укажите факторы, определяющие равновесие (примеры).
17. Вычислите молярность раствора карбоната натрия, если в 250,0 мл раствора содержится 1,000 грамм х.ч. Na2CO3?
18. Вычислите объем соляной кислоты (плотность 1,19 г/см3), который нужно взять для приготовления 500,0 мл 0,5000 N раствора.
19. Вычислите молярность 20%-го раствора серной кислоты, плотность которого 1,14 г/см3.
20. Какой объем 10,0000 N раствора HCl следует добавить к 500,0 мл воды для получения 2,0%-го раствора HCl.
21. Какой объем 8,0000 N раствора NaOH требуется для приготовления 1 л 5,0%-го раствора плотностью 1,06 г/см3.
22. До какого объема следует разбавить 700,0 мл 0,2464 N раствора, чтобы получить 0,2000 N раствора? Сколько воды следует добавить при этом?
23. Сколько мл 2,0000 N раствора азотной кислоты нужно взять для приготовления 3 л 0,1000 N раствора?
24. Сколько мл 20,0%-го раствора соляной кислоты (плотность 1,098 г/см3) нужно взять для приготовления 5 л 0.1000 N раствора?
25. Вычислите молярность раствора серной кислоты плотностью 1, 435 г/см3.
26. 75,00 мл раствора соляной кислоты плотностью d = 1,1 г/см3 разбавили до 900,0 мл. Определите нормальность полученной кислоты.
27. Насыщенный раствор хлорида серебра содержит в 1 л 0,00188 г AgCl при температуре 250С. Вычислите произведение растворимости этой соли (формульная масса соли 143,3 г).
28. Вычислите произведение растворимости соединения MgNH4PO4, если в 300,0 мл насыщенного раствора содержится 2,59·10-3 граммов этой соли (формульная масса соли 137,4 г).
29. Вычислите растворимость BaCrO4 в г/дм3: 1) в воде; 2) в 0,10 М растворе K2CrO4.
30. Вычислите растворимость AgCl в г/дм3: 1) в воде; 2) в 0,10 М растворе KCl.
31. К раствору, содержащему 0,10 моль/дм3 Pb(NO3)2 и 0,10 моль/дм3 Hg2(NO3)2, постепенно добавляют раствор KCl. Какой из катионов Pb2+ или Hg22+ начнет осаждаться первым?
32. Вычислите произведение растворимости Fe(OH)3, если растворимость его в воде равна 2·10-3г/дм3.
33. Насыщенный раствор иодида серебра содержит 2,11·10-9г AgI в 1 л при температуре 250С. Вычислите произведение растворимости этой соли (формульная масса соли 234,8 г).
34. Вычислите, выпадает ли осадок PbCl2 (ПР = 1,6·10-5) при смешении 0,01 М раствора Pb(NO3)2 с равным объемом 0,01 М раствора НCl. Если осадок PbCl2 не выпадает, то что нужно сделать, чтобы осадить свинец из раствора ?
35. Растворимость СаSO4 равна 1 г/дм3. Этот насыщенный раствор сульфата кальция смешивают с равным объемом раствора оксалата аммония (NH4)2С2О4, содержащим 0,0248 г соли в 1 л. Вычислите произведение концентраций [Са2+]·[С2О42-] в момент сливания растворов и решите, образуются ли осадок СаС2О4 (ПР 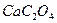 = 2,3·10-9).
= 2,3·10-9).
36. Как повлияет на растворимость СаС2О4 присутствие в растворе Na2С2О4 в концентрации 0,10 М (ПР (СаС2О4) = 2,3·10-9)?
37. К 1 л 0,1000 N раствора соляной кислоты прибавили 0,1000 моля гидроксида натрия. Как изменился рН раствора?
38. Вычислите рН раствора, содержащего 1,00 г соляной кислоты в 1 л раствора.
39. Вычислите рН раствора, содержащего 1,20 г уксусной кислоты в 200,0 мл раствора. К 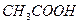 = 1,8·10-5.
= 1,8·10-5.
40. Вычислите рН раствора, полученного растворением 1,68 г гидроксида калия в 300,0мл воды.
41. Вычислите рН раствора, полученного разбавлением 10,0 мл 0,1000 N раствора аммиака до 50,00 мл. К 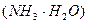 = 1,74·10-5.
= 1,74·10-5.
42. Вычислите рН раствора, полученного разбавлением 5,0 мл 27%-ного раствора гидроксида калия до 300,0 мл
43. Вычислите рН 0,25%-ного раствора, аммиака. К 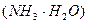 =1,74•10-5.
=1,74•10-5.
44. Вычислите рН раствора, полученного разбавлением водой 200,0 мл 12%-ного раствора азотной кислоты до 2000,0 мл.
45. Вычислите рН раствора, полученного разбавлением водой 50,00 мл 18%-ного раствора гидроксида натрия до 250,0 мл.
46. Вычислите Н+ и рН 0,0500 N раствора муравьиной кислоты. КНСООН = 1,8·10-4.
47. Вычислите рН ацетатной буферной смеси, содержащей по 0,10 молю кислоты и соли. Как изменится рН при добавлении к 1 л смеси 0,01 моля кислоты ? К 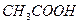 = 1,8·10-5.
= 1,8·10-5.
48. Сколько мл 5%-ного раствора ВаCl2 нужно взять для осаждения сульфат иона из 10,00 мл 1%-ного раствора серной кислоты ?
49. Сколько мл 5%-ного раствора аммиака нужно взять для осаждения гидроксида железа из навески 0,5263 г руды, содержащей 12% железа ?
50. Сколько мл 5%-ного раствора хлорида кальция нужно взять для осаждения иона фтора из навески 0,7956 г фторида натрия ?
51. Сколько мл 3%-ного раствора оксалата аммония нужно взять для осаждения кальция в виде оксалата из навески 0,5617 г карбоната кальция ?
52. Сколько мл 2,0000 N раствора серной кислоты нужно взять для осаждения бария из раствора, содержащего 0,6243 г ВаCl2 ?
53. Сколько мл 4%-ного раствора серной кислоты нужно взять для осаждения бария из 0,5566 г ВаCl2 ?
54. Сколько мл 3% ВаCl2 нужно взять для осаждения сульфат иона из 20,00мл 0,5% серной кислоты ?
55. Сколько мл 5%-ного раствора серной кислоты нужно взять для осаждения бария из раствора, содержащего 0,4859 г безводного ВаCl2 ?
56. Сколько мл 2,5%-ного раствора хлорида магния нужно взять для осаждения MgNH4РО4 из навески 0,5034 г безводного фосфата натрия Nа3РО4 ?
57. Сколько мл 5%-ного раствора серной кислоты нужно взять для осаждения стронция из навески 0,6327 г безводного хлорида стронция ?
58. Какие требования предъявляются в титриметрическом методе анализа к исходным веществам ?
59. Как подбирают индикатор при титровании кислотами и щелочами ? Что такое точка эквивалентности ?
60. Что такое скачок титрования ? Как, используя кривую титрования, правильно выбрать индикатор ?
61. Как, зная константу диссоциации (ионизации) кислотно-основных индикаторов, найти интервал рН изменения окраски этих индикаторов рH?
62. Приведите кривую титрования 0,1000 N раствора карбоната натрия 0,1000 N раствором соляной кислоты. Укажите рН среды в точках "эквивалентности" при титровании с индикаторами фенолфталеином и c метиловым оранжевым.
63. Приведите кривую титрования раствора аммиака раствором соляной кислоты. Укажите рН среды в точке эквивалентности. Обоснуйте выбор индикатора.
64. Приведите кривую титрования раствора муравьиной кислоты раствором гидроксида калия. Укажите рН среды в точке эквивалентности. Обоcнуйте выбор индикатора.
65. Какая реакция лежит в основе метода кислотно-основного титрования ? Как меняется рН раствора при титровании слабой кислоты сильным основанием ? В какой среде находится точка эквивалентности ?
66. Можно ли титровать 0,1 N раствора гидроксида натрия 0,1 N раствором соляной кислоты с индикатором нитрамином (рТ = 12)? Приведите кривую титрования и с ее помощью решите вопрос о возможности применения индикатора нитрамина.
67. Рассчитайте навеску х.ч. карбоната натрия, если на титрование израсходовано 25,00 мл НCl с титром по гидроксиду натрия 0,008000 г/мл ?
68. На титрование навески 0,1560 г х.ч. янтарной кислоты израсходовано 25,00 мл гидроксида натрия. Вычислите нормальность раствора гидроксида натрия и его титр по соляной кислоте.
69. Для приготовления стандартного раствора карбоната натрия взяли навеску 1,3250 г х.ч. Nа2СО3, растворили ее и разбавили раствор водой в мерной колбе до объема 250,00 мл. Вычислите титр карбоната натрия по соляной кислоте.
70. Рассчитайте содержание СН3СООН в растворе, если на титрование пошло 20,00 мл гидроксида натрия с титром 0,04614 г/мл. Вычислите титр гидроксида натрия по уксусной кислоте.
71. На титрование раствора, содержащего х.ч. карбонат натрия, израсходовано 20,00 мл 0,1200 N раствора соляной кислоты. Вычислите титр НСl по карбонату натрия и содержание Nа2СО3.
72. Рассчитайте навеску х.ч. щавелевой кислоты для приготовления 500,0 мл 0,1000 N раствора и вычислите титр полученного раствора Н2С2О4·2Н2О по КОН.
73. На титрование раствора, содержащего 1,0250 г х.ч. Н2С2О4·2Н2О требуется 25,00 мл гидроксида натрия. Вычислите титр и нормальность раствора гидроксида натрия, а также титр его по щавелевой кислоте.
74. Рассчитайте титр раствора соляной кислоты по гидроксиду натрия, если на титрование раствора, содержащего 0,2167 г х.ч. карбоната натрия требуется 21,00 мл этого раствора.
75. На титрование 20,00 мл раствора соляной кислоты с титром 0,003512 г/мл израсходовано 25,00 мл раствора гидроксида натрия. Вычислите титр NаОН по НСl и титр NаОН по Н2SО4.
76. Для нейтрализации 20,00 мл 0,1000 N раствора соляной кислоты потребовалось 8,00 мл раствора гидроксида натрия. Определите титр и весовую процентную концентрацию раствора гидроксида натрия.
77. Навеску образца 0, 1535 г оксида магния растворили в 40,00 мл соляной кислоты с титром 0,003646 г/мл. На титрование избытка кислоты израсходовано 7,50 мл NаОН с титром 0,004040 г/мл. Вычислить процентное содержание MgО в образце.
78. На титрование раствора, содержащего 3,5580 г технического КОН, израсходовано 28,00 мл раствора НСl с титром по NаОН 0,07492 г/мл. Вычислите процентное содержание КОН в образце.
79. Навеску 2,2418 г технического тетрабората натрия растворили в мерной колбе емкостью 100,00 мл. На титрование 20,00 мл этого раствора израсходовано 25,50 мл соляной кислоты с титром по гидроксиду натрия 0,003974 г/мл. Вычислите процентное содержание тетрабората натрия Nа2В4О7·10 Н2О в образце.
80. На титрование раствора, содержащего 3,2002 г КОН, пошло 28,00 мл раствора НСl, титр которого по NаОН равен 0,06400 г/мл. Вычислите процентное содержание КОН в образце.
81. Навеску 1,0606 г х.ч. карбоната натрия растворили в мерной колбе объемом 100,0 мл. На титрование 20,00 мл этого раствора в присутствии индикатора метилового оранжевого израсходовано 25,75 мл раствора НСl. Вычислите нормальность и титр раствора НСl.
82. Навеску 0,6000 г х.ч. Н2С2О4·2Н2О растворили в мерной колбе объемом 100,0 мл. На титрование 10,00 мл этого раствора израсходовано 9,52 мл NаОН. Вычислите нормальность раствора NаОН и его титр по щавелевой кислоте.
83. Навеску 0,3950 г известняка растворили в 50,00 мл 0,1295 N раствора НСl. На титрование избытка кислоты израсходовано 10,55 мл раствора NаОН с титром 0,004465 г/мл. Вычислите процентное содержание СаСО3 в образце.
84. Навеска образца оксида цинка 0,2046 г растворена в 50,00 мл раствора серной кислоты с титром 0,004904 г/мл. Избыток кислоты оттитрован 10,00 мл раствора NаОН с титром 0,004040 г/мл. Вычислите процентное содержание ZnO в образце.
85. Навеску 2,6835 г соды растворили в мерной колбе объемом 250,00 мл. На титрование 25,00 мл этого раствора израсходовано 20,55 мл раствора НСl с титром по Nа2СО3 0,005300 г/мл. Вычислите процентное содержание Nа2СО3 в образце.
86. Навеску 0,5000 г карбоната кальция растворили в 25,00 мл 0, 5100 N раствора соляной кислоты. Избыток кислоты был оттитрован 6,50 мл 0,4900 N раствора NаОН. Вычислите процентное содержание карбоната кальция СаСО3 в образце.
87. Опишите устройство стандартного водородного электрода. Стандартные потенциалы. Уравнение Нернста.
88. В чем заключается сущность перманганатометрии? Почему перманганатометрические определения проводят преимущественно в кислой среде? Рассчитайте величины молярных масс эквивалента КМnО4 в кислой, нейтральной и щелочной средах.
89. Сколько г кальция содержится в 250,0 мл раствора СаСl2, если после прибавления к 25,00 мл его 40,00 мл 0,1000 N раствора оксалата аммония и отделения образовавшегося осадка Са2С2О4 на титрование избытка (NH4)2C2O4 израсходовано 15,00 мл 0,0200 N раствора КМnО4 ?
90. На титрование 0,1136 г х.ч. Na2С2О4 в кислой среде израсходовано 20,75 мл КМnО4. Определите нормальность раствора КМnО4 и его титр по железу (II).
91. Определите процентное содержание олова в сплаве, если на титрование раствора, полученного из 0,9122 г сплава, израсходовано 15,73 мл 0,0200 N раствора йода?
92. К 10,00 мл. раствора медного купороса в сернокислой среде прибавили избыток раствора иодида калия. На титрование выделившегося йода в присутствии крахмала израсходовано 20,00 мл 0,0500 мл раствора тиосульфата натрия. Вычислить содержание меди в г в объеме пробы 250 мл и титр тиосульфата натрия по йоду. Написать уравнения протекающих реакций.
93. К 25,00 мл хлорной воды прибавили избыток иодида калия. На титрование выделившегося йода израсходовано 20,10 мл 0,1100 N раствора тиосульфата натрия. Сколько граммов хлора содержит 1 литр хлорной воды?
94. Навеска 0,2000 г руды, содержащей МnО2, была обработана избытком концентрированной соляной кислоты. Образовавшийся при реакции хлор был отогнан и поглощен раствором иодида калия. На титрование выделившегося при этом йода пошло 42,50 мл 0,0520 N раствора тиосульфата натрия. Сколько процентов МnО2, содержит руда?
95. К 25,00 мл раствора дихромата калия прибавлен избыток иодида калия и серная кислота; на титрование выделившегося йода израсходовано 30,00 мл 0,1000 N раствора тиосульфата натрия. Сколько граммов К2Сr2О7 содержит один литр раствора?
96. На титрование йода, выделившегося при обработке навески PbO2 иодидом калия в кислой среде, израсходовано 25,00 мл раствора тиосульфата натрия с титром 0,02480 г/мл. Сколько граммов PbO2 содержится в навеске?
97. В мерной колбе емкостью 250 мл растворили 0,7112 г х.ч. оксалата аммония (NH4)2C2O4·2Н2О. Какой объем перманганата калия, титр которого 0,001420 г/мл, пойдет на титрование 25,00 мл полученного раствора оксалата аммония? (Среда кислая).
98. Какие требования предъявляются к реакциям осаждения, используемых в титриметрическом анализе? Какие методы осаждения Вам известны?
99. На какой реакции комплексонометрического метода анализа основано определение жесткости воды? В каких единицах она выражается? Напишите уравнения реакции комплексона III с ионами Са2+.
100. В чем сущность роданометрического определения содержания хлора? Укажите титрант, индикатор и рН среды. Напишите уравнения реакций. Каковы преимущества этого метода по сравнению с методом Мора?
